Химия - Адсорбция - Схожие явления
28 февраля 2011Оглавление:
1. Адсорбция
2. Схожие явления
3. Значение адсорбции
В предыдущем разделе говорилось о случае протекания гетерогенной реакции на поверхности- хемосорбции. Однако бывают случаи гетерогенных реакций по всему объему, а не только на поверхности- это обычная гетерогенная реакция. Поглощение по всему объёму может проходить и под воздействием физических сил- этот случай называется абсорбцией.
| Виды взаимодействий | Взаимодействия только на поверхности | Взаимодействия по всему объёму |
|---|---|---|
| Физические | Адсорбция | Абсорбция |
| Химические | Хемосорбция | Гетерогенная реакция |
Физическая адсорбция
Причиной адсорбции являются неспецифические Ван-дер-Ваальсовы силы. Адсорбция, осложнённая химическим взаимодействием между адсорбентом и адсорбатом, является особым случаем. Явления такого рода называют хемосорбцией и химической адсорбцией. «Обычную» адсорбцию в случае, когда требуется подчеркнуть природу сил взаимодействия, называют физической адсорбцией.
Физическая адсорбция является обратимым процессом, условие равновесия определяется равными скоростями адсорбции молекул адсорбтива P на вакантных местах поверхности адсорбента S и десорбции — освобождения адсорбата из связанного состояния S − P:
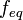 ;
;
уравнение равновесияя в таком случае:
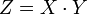 ,
,
где константа равновесия, и — доли поверхности адсорбента, занятые и незанятые адсорбатом, а — концентрация адсорбтива.
Количественно процесс физической мономолекулярной адсорбции в случае, когда межмолекулярным взаимодействием адсорбата можно пренебречь, описывается уравнением Ленгмюра:
 ,
,
где θ — доля площади поверхности адсорбента, занятая адсорбатом, α — адсорбционный коэффициент Ленгмюра, а P — концентрация адсорбтива.
Поскольку = θ и, соответственно, = 1 − θ, уравнение адсорбционного равновесия может быть записано следующим образом:
Уравнение Ленгмюра является одной из форм уравнения изотермы адсорбции. Под уравнением изотермы адсорбции понимают зависимость равновесной величины адсорбции от концентрации адсорбтива a=f при постоянной температуре. Концентрация адсорбтива для случая адсорбции из жидкости выражается, как правило, в мольных либо массовых долях. Часто, особенно в случае адсорбции из растворов, пользуются относительной величиной: С/Сs, где С — концентрация, Сs — предельная концентрация адсорбтива при данной температуре. В случае адсорбции из газовой фазы концентрация может быть выражена в единицах абсолютного давления, либо, что особенно типично для адсорбции паров, в относительных единицах: P/Ps, где P — давление пара, Ps — давление насыщенных паров этого вещества. Саму величину адсорбции можно выразить также в единицах концентрации. Для адсорбции на твёрдых адсорбентах, особенно при рассмотрении практических задач, используют отношение массы или количества поглощённого вещества к массе адсорбента, например мг/г или ммоль/г.
Просмотров: 4030
|
|
