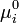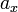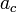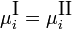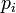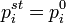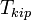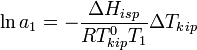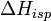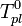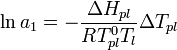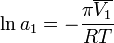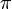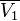Химия - Активность (химия) - Методы определения активности
06 мая 2011Описание казино Frank на сайте.
Оглавление:
1. Активность (химия)
2. Выбор стандартного состояния
3. Методы определения активности
Экспериментальные методы определения активности компонентов в растворе основаны на изучении какого-либо гетерогенного равновесия в системе. При рассмотрении этих методов следует помнить, что в условиях равновесия химические потенциалы i-го компонента в разных фазах равны:
Это соотношение является исходной точкой для вывода расчетных уравнений в некоторых из методов определения активности. Кроме того, активности компонентов в некоторой фазе связаны между собой уравнением:
По равновесному давлению пара
В основе этого метода лежит соотношение:
где 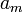 — парциальное давление пара компонента над раствором, а
— парциальное давление пара компонента над раствором, а  — давление пара этого компонента для стандартного состояния. Соответственно, если за стандартное состояние принято состояние чистого компонента, то
— давление пара этого компонента для стандартного состояния. Соответственно, если за стандартное состояние принято состояние чистого компонента, то 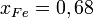 .
.
Эксериментальные методы определения давления пара компонентов над раствором весьма разнообразны; выбор того или иного из них определяется, в частности, исследуемой системой.
По повышению температуры кипения раствора
Температура кипения раствора 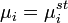 выше температуры кипения чистого растворителя
выше температуры кипения чистого растворителя 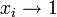 . Данные об изменении температуры кипения раствора могут быть использованы для расчета активности растворителя, в соответствии с уравнением:
. Данные об изменении температуры кипения раствора могут быть использованы для расчета активности растворителя, в соответствии с уравнением:
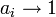 ,
,
где 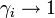 — теплота испарения растворителя, в интервале от температуры кипения чистого растворителя до температуры кипения раствора принимаемая постоянной. Индексом «1» обычно обозначается растворитель.
— теплота испарения растворителя, в интервале от температуры кипения чистого растворителя до температуры кипения раствора принимаемая постоянной. Индексом «1» обычно обозначается растворитель.
По понижению температуры замерзания раствора
Температура замерзания раствора 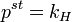 ниже температуры замерзания чистого растворителя
ниже температуры замерзания чистого растворителя 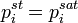 . Соответственно, активность растворителя можно рассчитать, используя зависимость:
. Соответственно, активность растворителя можно рассчитать, используя зависимость:
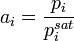 ,
,
где 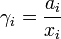 — теплота плавления растворителя.
— теплота плавления растворителя.
По осмотическому давлению раствора
Величина осмотического давления раствора может быть использована для определения активности растворителя в соответствии с соотношением:
где 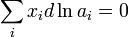 — осмотическое давление,
— осмотическое давление, 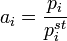 — парциальный молярный объём растворителя.
— парциальный молярный объём растворителя.
По распределению компонента между конденсированными фазами
Активность компонента раствора можно определить, изучая равновесное распределение его между двумя контактирующими конденсированными фазами, одна из которых — исследуемый раствор, а для другой активность или коэффициент активности уже известны. В общем случае:
В частности, если выбор стандартного состояния компонента для фаз таков, что 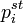 , это выражение принимает более простой вид:
, это выражение принимает более простой вид:
Экспериментально в этом методе определяют равновесные концентрации компонента или коэффициент распределения компонента между растворами.
По равновесию химической реакции с газовой фазой
При исследовании оксидных расплавов активность компонентов часто определяют, используя следующие химические реакции:
- MeO + H2 = Me + H2O
- MeO + CO = Me + CO2
Для первой из приведенных реакций константа равновесия имеет вид:
Если оксидный и металлический расплавы взаимно нерастворимы и восстанавливается индивидуальный оксид, то 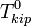 , и тогда:
, и тогда:
Если металл выделяется в виде сплава с другими компонентами или растворяется в фазе-коллекторе, его активность не равна единице и формула принимает вид:
Активность металла в сплаве здесь должна быть известна из независимых измерений.
Опытным путем в данном методе определяют отношение 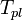 .
.
Кроме того, активность оксидного компонента связана с равновесным давлением кислорода над расплавом, с учетом реакций в газовой фазе, например:
или
Тогда можно показать, что 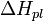
Для сульфидных расплавов используют реакцию:
или:
По значению э. д. с. гальванического элемента
Электродвижущая сила концентрационной цепи с переносом может быть выражена следующим соотношением:
Соответственно, такую цепь можно использовать для нахождения активности и коэффициента активности. В некоторых случаях побочное взаимодейтсвие электролита с электродами может приводить к невозможности определения активности компонентов по ЭДС цепи, тогда используют концентрационные цепи без переноса. Нахождение активности компонента по ЭДС концентрационной цепи без переноса — один из самых точных способов определения активности .
Просмотров: 6787
|
|