Химия - Амфотерность - Амфотерность как химическое свойство
28 февраля 2011Оглавление:
1. Амфотерность
2. Амфотерность как химическое свойство
Амфотерность как химическое свойство вещества может проявляться по-разному:
1. В рамках теории электролитической диссоциации это способность вещества к электролитической диссоциации как по механизму кислот, так и по механизму оснований. Электролиты, которые в растворе ионизируются одновременно по кислотному и основному типам называются амфолитами. Если обозначить амфотерный электролит формулой ROH, то его диссоциацию можно описать схемой:
- H + RO
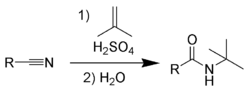 ROH
ROH  R + OH
R + OH

Например, кислотно-основные свойства азотистой кислоты определяются равновесными процессами диссоциации с образованием нитрит-аниона и нитрозильного катиона:
- HNO2
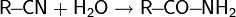 H + NO2
H + NO2 - HNO2
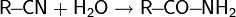 NO + OH.
NO + OH.
Идеальным амфолитом будет вода:
- H2O
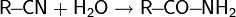 H + O
H + O
Также к числу идеальных амфолитов относят гидроксид галлия Ga3, вторые и третьи константы диссоциации которого по кислотному и основному типам практически одинаковы.
2. В рамках протолитической теории Брёнстеда-Лоури проявление амфотерности рассматривается как способность протолита выступать донором и акцептором протона. Например, для воды амфотерность проявляется как автопротолиз:
- H2O + H2O
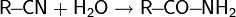 H3O + OH
H3O + OH
Амфолитами также будут вещества, имеющие в своём составе функциональные группы, способные быть донорами и акцепторами протонов. Например, к амфотерным органическим электролитам относятся белки, пептиды и аминокислоты. Так аминокислоты имеют в своём составе, по крайней мере, карбоксильную группу –COOH и аминогруппу –NH2. В растворе эти группы подвергаются частичной ионизации:
- R–COOH + H2O
 R–COO + H3O
R–COO + H3O - R–NH2 + H2O
 R–NH3 + OH
R–NH3 + OH
Таким образом, молекула аминокислоты находится в двух равновесных формах, заряженной и незаряженной. В этих комбинациях R–COOH и R–NH3 являются потенциальными кислотами, а R–COO и R–NH2 – сопряженными потенциальными основаниями.
3. Амфотерность может проявляться как способность вещества к взаимодействию как с кислотами, так и с основаниями. Это характерно для оксидов, гидроксидов и комплексных соединений некоторых p-элементов и большинства d-элементов в промежуточных степенях окисления. Амфотерность в той или иной степени является общим свойством гидроксидов. Например, для соединений хрома известны реакции:
- Cr + 3HCl
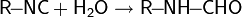 CrCl3 + 3H2O
CrCl3 + 3H2O - Cr + NaOH + 2H2O
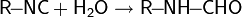 Na
Na - Cr2O3 + 6HCl
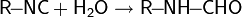 2CrCl3 + 3H2O
2CrCl3 + 3H2O - Cr2O3 + Na2CO3
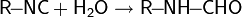 2NaCrO2 + CO2
2NaCrO2 + CO2
Не соответствуют действительности традиционные представления о проявлении амфотерности гидроксидов как диссоциации по кислотному и основному типам. В общем виде амфотерное поведение нерастворимых гидроксидов хрома, алюминия, цинка может описано как реакции ионного обмена ионов среды с лигандами H2O и OH. Например, для Al ионные равновесия могут быть записаны следующим образом:
- + 3H3O
 Al6 + 3H2O
Al6 + 3H2O - + 3OH
 Al6.
Al6.
4. В ряде случаев важным косвенным признаком амфотерности является способность элемента образовывать два ряда солей, катионного и анионного типа. Например, для цинка: ZnCl2,SO4 и Na2ZnO2, Na24).
Просмотров: 4159
|
|