Химия - Автопротолиз - Константа автопротолиза
01 марта 2011Оглавление:
1. Автопротолиз
2. Константа автопротолиза
3. Автопротолиз воды
Применение закона действующих масс к равновесной гомофазной реакции автопротолиза позволяет получить количественную характеристику — константу автопротолиза растворителя KS. Термин «константа автопротолиза» используется обычно в протолитической теории, а «ионное произведение» — в теории электролитической диссоциации.
Для протонного растворителя HL может быть записана соответствующая константа равновесия:
Kс = · / = Const = f
Степень протолиза очень мала и, следовательно, равновесная молярная концентрация непротолизованных молекул растворителя практически равна исходной концентрации этого растворителя CHL, то есть постоянна.
Объединяя постоянные Kс и в одну константу Kс · и обозначая ее Ks, получим выражение:
Ks = . = Const = f.
Величина Ks — константа автопротолиза или ионное произведение растворителя — служит количественной характеристикой реакции автопротолиза данного растворителя. Константа автопротолиза является постоянной величиной для данной температуры и данного растворителя.
Например, для уксусной кислоты:
CH3COOH + CH3COOH ![]() CH3COO + CH3COOH2; Ks = 2,5·10
CH3COO + CH3COOH2; Ks = 2,5·10
Поскольку значения констант автопротолиза очень малы, на практике для удобства пользуются величиной, которая называется «показатель константы автопротолиза». Она рассчитывается как отрицательный десятичный логарифм константы автопротолиза:
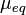 .
.
Показатели констант автопротолиза некоторых растворителей приведены в таблице.
| Растворитель | pKs |
|---|---|
| Диметилсульфоксид | 33,3 |
| Аммиак | 32,5 |
| Ацетонитрил | 32,2 |
| Метилэтилкетон | 25,7 |
| Гидразин | 24,7 |
| трет-Бутиловый спирт | 22,8 |
| Изоамиловый спирт | 21,4 |
| Ацетон | 21,1 |
| Уксусная кислота | 14,45 |
| Вода | 14,0 |
| Фтороводород | 10,0 |
| Муравьиная кислота | 6,30 |
| Серная кислота | 5,0 |
Просмотров: 8857
|
|