Химия - Бор (элемент) - Получение
19 мая 2011Оглавление:
1. Бор (элемент)
2. История и происхождение названия
3. Получение
4. Применение
5. Биологическая роль
Наиболее чистый бор получают пиролизом бороводородов. Такой бор используется для производства полупроводниковых материалов и тонких химических синтезов.
1. Метод металлотермии:


2. Термическое разложение паров бромида бора на раскаленной вольфрамовой проволоке в присутствии водорода:

Физические свойства

Чрезвычайно твёрдое вещество, карбиду бора, сплаву бор-углерод-кремний, карбиду скандия-титана). Обладает хрупкостью и полупроводниковыми свойствами.
В природе бор находится в виде двух изотопов В и В.
В имеет очень высокое сечение поглощения тепловых нейтронов, поэтому В в составе борной кислоты применяется в атомных реакторах для регулирования реактивности.
Химические свойства

По многим физическим и химическим свойствам неметалл бор напоминает кремний.
Химически бор довольно инертен и при комнатной температуре взаимодействует только со фтором:
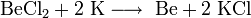 .
.
При нагревании бор реагирует с другими галогенами с образованием тригалогенидов, с азотом образует нитрид бора BN, с фосфором — фосфид BP, с углеродом — карбиды различного состава. При нагревании в атмосфере кислорода или на воздухе бор сгорает с большим выделением теплоты, образуется оксид B2O3:
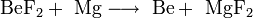
С водородом бор напрямую не взаимодействует, хотя известно довольно большое число бороводородов различного состава, получаемых при обработке боридов щелочных или щелочноземельных металлов кислотой:

При сильном нагревании бор проявляет восстановительные свойства. Он способен, например, восстановить кремний или фосфор из их оксидов:


Данное свойство бора можно объяснить очень высокой прочностью химических связей в оксиде бора B2O3.
При отсутствии окислителей бор устойчив к действию растворов щелочей. В горячей азотной, серной кислотах и в царской водке бор растворяется с образованием борной кислоты  .
.
Оксид бора  — типичный кислотный оксид. Он реагирует с водой с образованием борной кислоты:
— типичный кислотный оксид. Он реагирует с водой с образованием борной кислоты:

При взаимодействии борной кислоты со щелочами возникают соли не самой борной кислоты — бораты, а тетрабораты, например:

Просмотров: 7402
|
|