Химия - Бромид алюминия - Химические свойства
28 февраля 2011Оглавление:
1. Бромид алюминия
2. Химические свойства
3. Применение
- Безводный бромид алюминия очень энергично реагирует с водой выделяя при растворении много тепла и, частично гидролизуясь:
- При нагревании вводного раствора гидролиз можно провести полностью:
- Вступает в реакцию со щелочами:
- При пропускании безводного сероводорода через раствор бромида алюминия в сероуглероде выпадает осадок комплексного соединения:
- При высокой температуре разлагается:
- При нагревании бромида алюминия с алюминием в газовой фазе образуется нестабильный монобромид алюминия:
- С гидридом лития образует алюмогидрид:
- Бромид алюминия — сильный акцептор электронных пар — легко присоединяет молекулы доноры:
Получение
Безводный бромид алюминия получают взаимодействием элементов при нагревании:
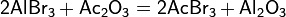
Водный раствор можно получить реакцией алюминиевой стружки с бромоводородной кислотой:
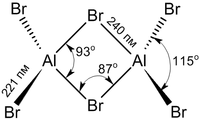
Просмотров: 5129
|
|