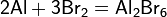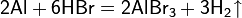Химия - Бромид диртути(2+) - Получение
14 августа 2011Оглавление:
1. Бромид диртути(2+)
2. Получение
Бромид диртути может быть получен:
- взаимодействием бромида ртути и металлической ртути при высокой температуре :
- с помощью реакций ионного обмена, например осаждением бромидом калия из раствора нитрата диртути в разбавленной азотной кислоте
- анодным растворением ртути в бромомоводородной кислоте
- на аноде
- на катоде

Применение
Бромид диртути применяют как компонент электролитов при рафинировании металлической ртути, для электрохимических экспериментов, для синтеза ртутьорганических соединений.
Токсичность
Бромид диртути является токсичным веществом. Оказывает раздражающее действие на кожу, глаза, органы дыхания. При попадании внутрь организма главным образом поражает почки, нервную ткань и органы ЖКТ.
Является очень токсичным для водных организмов. Может оказывать долговременное вредное воздействие на водную среду.
ПДК составляет: в воздухе рабочей зоны 0,2 мг/м³; в атмосферном воздухе 0,0003 мг/м³; в воде водоемов 0,001 мг/л.
Просмотров: 2347
|
|