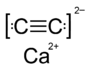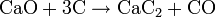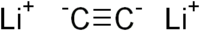Химия - Бромоводород - Химические свойства
01 марта 2011Оглавление:
1. Бромоводород
2. Химические свойства
Водный раствор бромистого водорода образует сильную одноосновную кислоту:
Термически HBr очень устойчив, при температуре 1000 °C разлагаются около 0,5 % молекул:
Как кислота реагирует с металлами, их оксидами, основаниями:
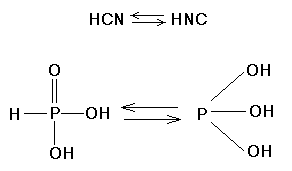
Является восстановителем, медленно окисляется на воздухе, из-за чего водные растворы, со временем, окрашиваются в бурый цвет:
Применение
Применяют для приготовления бромидов, синтеза различных органических бромпроизводных.
Транспортировка
Безводный HBr транспортируют в баллонах ёмкостью 6,8 и 68 кг под давлением 24 атм.
Токсичность
Предельно допустимая концентрация = 10 мг/м³, поражающая токсодоза = 2,4 мг/л·мин.
Просмотров: 4764
|
|