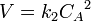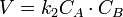Химия - Энергия активации - Математическое описание
01 марта 2011Оглавление:
1. Энергия активации
2. Математическое описание
3. Переходное состояние
Уравнение Аррениуса устанавливает связь между энергией активации и скоростью протекания реакции:
k — константа скорости реакции, A — фактор частоты для реакции, универсальная газовая постоянная, T — температура в кельвинах.
С повышением температуры растёт вероятность преодоления энергетического барьера.
Для количественного описания температурных эффектов в химической кинетике для приближённых вычислений кроме уравнения Аррениуса используют правило Вант-Гоффа: повышение температуры на 10 К увеличивает для большинства реакций скорость в 2-4 раза. Математически это означает, что скорость реакции зависит от температуры степенным образом:
где γ — температурный коэффициент скорости. Правило Вант-Гоффа является весьма грубым и применимо только в очень ограниченном интервале температур.
Просмотров: 3629
|
|