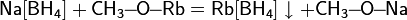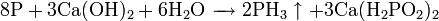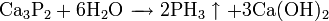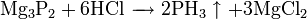Химия - Фосфин - Химические свойства
01 марта 2011Оглавление:
1. Фосфин
2. Химические свойства
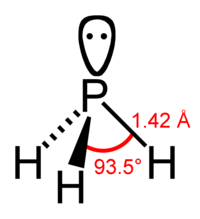
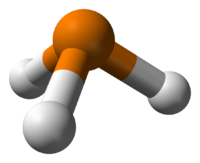
Фосфин сильно отличается от его аналога аммиака. Его химическая активность выше, чем у аммиака, он плохо растворим в воде, как основание значительно слабее аммиака. Последнее объясняется тем, что связи H-P поляризованы слабо и активность неподелённой пары электронов у фосфора ниже, чем у азота в аммиаке.
В отсутствие кислорода при нагревании разлагается на элементы:
на воздухе самопроизвольно воспламеняется:
Проявляет сильные восстановительные свойства:
При взаимодействии с сильными донорами протонов фосфин может давать соли фосфония, содержащие ион PH4. Соли фосфония, бесцветные кристаллические вещества, крайне неустойчивы, легко гидролизуется.
Как и сам фосфин, так и его соли являются сильными восстановителями.
Токсичность
Фосфин сильно ядовит, действует на нервную систему, нарушает обмен веществ. ПДК = 0,1 мг/м³. Запах ощущается при концентрации 2-4 мг/м³, длительное вдыхание при концентрации 10 мг/м³ приводит к летальному исходу.
Просмотров: 6279
|
|