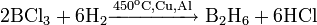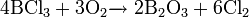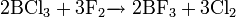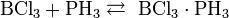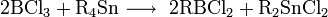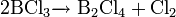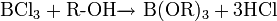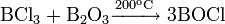Химия - Фторид диртути(2+)
14 августа 2011Оглавление:
1. Фторид диртути(2+)
2. Получение
неорганическое вещество с формулой Hg2F2, соединение ртути и фтора. Относится к классу бинарных содинений, может рассматриваться как димер соли одновалентной ртути и фтороводородной кислоты. Кристаллическое вещество светло-жёлтого цвета.
Физические свойства
Фторид диртути при нормальных условиях — твёрдое вещество светло-жёлтого цвета малорастворимое в воде. Плавится без разложения при 570 °C. Не образует кристаллогидратов. Имеет тетрагональную сингонию кристаллической решётки.
Химические свойства
Фторид диртути легко подвергается дисмутации с образованием металлической ртути и соединений ртути в различных условиях:
- на свету
- в горячей воде
- в разбавленной соляной кислоте
- в концентрированной щёлочи
- в растворе аммиака
Фторид диртути может быть полностью окислен до соединений ртути различными сильными окислителями, например:
- концентрированной серной кислотой
- газообразным хлором
- фторидом нитрозила
Просмотров: 2377
|
|