Химия - Фторид ксенона(II) - Химические свойства
15 июля 2011Оглавление:
1. Фторид ксенона(II)
2. Строение
3. Химические свойства
4. Применение
При возгонке дифторид ксенона диспропорционирует на свободный ксенон и тетрафторид ксенона:
- 2XeF2 → Xe + XeF4.
В холодной подкисленной воде разлагается достаточно медленно, зато в щелочной среде разложение идёт быстро:
- 2XeF2 + 4NaOH → 2Xe↑ + O2↑ + 4NaF + 2H2O.
Менее активный окислитель, чем молекулярный фтор.
Образование координационных соединений
XeF2 может выступать в качестве лиганда в комплексных соединениях. Например, в фтороводородном растворе возможна следующая реакция:
- Mg2 + 4 XeF2 →2.
Кристаллографический анализ показывает, что атом магния координирован 6 атомами фтора, 4 из которых являются мостиками между атомами магния и ксенона.
Известно множество реакций такого типаx, в которых в качестве атома M могут выступать Ca, Sr, Ba, Pb, Ag, La или Nd, а атомом A могут быть As, Sb или P.
Такие реакции требуют большого избытка дифторида ксенона.
В твердофазной системе в присутствии фторида цезия некоторые металлы могут образовывать комплексные соединения типа Cs3.
С пентафторидом мышьяка образуется гексафторарсенат трифтордиксенона, в котором в качестве катиона выступает молекулярный ион Xe2F3. Также известны соединения, где катионом является Xe2.
- AsF5 + 2XeF2 → Xe2F3.
Реакции фторирования с простыми веществами
XeF2 фторирует Mn, W, Nb, Sb, Sn, Ti, S, P, Te, Ge, Si до высших фторидов в интервале температур от −10 до +30 °C. Нагревание реакционной смеси до 50 °C приводит к взаимодействию дифторида ксенона с оксидами и солями многих металлов.
В твердофазной системе при нагревании окисляет Ce, Pr и Tb до тетрафторидов.
Реакции окисления
Водный раствор дифторида окисляет броматы до перброматов:
- KBrO3 + XeF2 + H2O → KBrO4 + Xe↑ + 2HF.
Окислительное фторирование
Пример окислительного фторирования для теллур-органического соединения:
- Ph3TeF + XeF2 → Ph3TeF3 + Xe↑
Восстановительное фторирование
Пример восстановительного фторирования:
- 2CrO2F2 + XeF2 → 2CrOF3 + Xe +O2
Фторирование ароматических соединений
Фторирование ароматических соединений идёт по механизму электрофильного замещения:
При этом возможно и восстановительное фторирование:
Фторирование непредельных соединений
Достаточно селективно можно проводить фторирование диеновых производных в 1,2-положения: 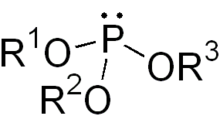 .
.
Фторирующее декарбоксилирование
Дифторид ксенона декарбоксилирует карбоновые кислоты, при этом образуются соответствующие фторалканы:
- RCO2H + XeF2 → RF + CO2↑ + Xe↑ + HF↑
Просмотров: 4614
|
|