Химия - Галогены - Физические свойства галогенов
28 февраля 2011Оглавление:
1. Галогены
2. Распространённость элементов и получение простых веществ
3. Физические свойства галогенов
Энергия связи галогенов сверху вниз по ряду изменяется не равномерно. Фтор имеет аномально низкую энергию связи, это объясняется тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов. От хлора к иоду энергия связи постепенно ослабевает, что связанно с увеличением атомного радиуса. Аналогичные аномалии имеет и температуры кипения.
, Cl2 −100.98, Br2 −7.2, I2 311.5, At2 411 C)
Химические свойства галогенов
Все галогены проявляют высокую окислительную активность, которая уменьшается при переходе от фтора к иоду. Фтор — самый активный из галогенов, реагирует со всеми металлами без исключения, многие из них в атмосфере фтора самовоспламеняются, выделяя большое количество теплоты, например:
2Al + 3F2 = 2AlF3 + 2989 кДж,
2Fe + 3F2 = 2FeF3 + 1974 кДж.
Без нагревания фтор реагирует и со многими неметаллами — все реакции при этом сильно экзотермические, например:
Н2 + F2 = 2HF + 547 кДж,
Si + 2F2 = SiF4 + 1615 кДж.
При нагревании фтор окисляет все другие галогены по схеме
Hal2 + F2 = 2НalF
где Hal = Cl, Br, I, причем в соединениях HalF степени окисления хлора, брома и иода равны +1.
Наконец, при облучении фтор реагирует даже с инертными газами:
Хе + F2 = XeF2 + 152 кДж.
Взаимодействие фтора со сложными веществами также протекает очень энергично. Так, он окисляет воду, при этом реакция носит взрывной характер:
3F2 + ЗН2О = OF2↑ + 4HF + Н2О2.
Свободный хлор также очень реакционноспособен, хотя его активность и меньше, чем у фтора. Он непосредственно реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов. Для сравнения приведем уравнения реакций хлора с теми же простыми веществами, что и для фтора:
2Al + 3Cl2 = 2AlCl3 + 1405 кДж,
2Fe + ЗCl2 = 2FeCl3 + 804 кДж,
Si + 2Cl2 = SiCl4 + 662 кДж,
Н2 + Cl2 = 2HCl+185кДж.
Особый интерес представляет реакция с водородом. Так, при комнатной температуре, без освещения хлор практически не реагирует с водородом, тогда как при нагревании или при освещении эта реакция протекает со взрывом по приведенному ниже цепному механизму:
Cl2 + hν → 2Cl,
Cl + Н2 → HCl + Н,
Н + Cl2 → HCl + Cl,
Cl + Н2 → HCl + Н и т. д.
Возбуждение этой реакции происходит под действием фотонов, которые вызывают диссоциацию молекул Cl2 на атомы — при этом возникает цепь последовательных реакций, в каждой из которых появляется частица, инициирующая начало последующей стадии.
Реакция между Н2 и Cl2 послужила одним из первых объектов исследования цепных фотохимических реакций. Наибольший вклад в развитие представлений о цепных реакциях внёс русский учёный, лауреат Нобелевской премии Н. Н. Семёнов.
Хлор вступает в реакцию со многими сложными веществами, например замещения и присоединения с углеводородами:
СН3-СН3 + Cl2 → СН3-СН2Cl + HCl,
СН2=СН2 + Cl2 → СН2Cl — СН2Cl.
Хлор способен при нагревании вытеснять бром или иод из их соединений с водородом или металлами:
Cl2 + 2HBr = 2HCl + Br2,
Cl2 + 2HI = 2HCl + I2,
Cl2 + 2KBr = 2KCl + Br2,
а также обратимо реагирует с водой:
Cl2 + Н2О = HCl + HClO — 25 кДж.
Хлор, растворяясь в воде и частично реагируя с ней, как это показано выше, образует равновесную смесь веществ, называемую хлорной водой.
Заметим также, что хлор в левой части последнего уравнения имеет степень окисления 0. В результате реакции у одних атомов хлора степень окисления стала −1, у других +1. Такая реакция — пример реакции самоокисления-самовосстановления, или диспропорционирования.
Хлор может таким же образом реагировать со щелочами:
Cl2 + 2NaOH = NaCl + NaClO + Н2О,
ЗCl2 + 6КОН = 5KCl + KClO3 + ЗН2О.
Химическая активность брома меньше, чем у фтора и хлора, но все же достаточно велика в связи с тем, что бром обычно используют в жидком состоянии и поэтому его исходные концентрации при прочих равных условиях больше, чем у хлора.
Для примера приведем реакции взаимодействия брома с кремнием и водородом:
Si +2Br2 = SiBr4 + 433 кДж,
Н2 + Br2 = 2HBr + 73 кДж.
Являясь более «мягким» реагентом, бром находит широкое применение в органической химии.
Отметим, что бром, так же, как и хлор, растворяется в воде, и, частично реагируя с ней, образует так называемую «бромную воду», тогда как иод практически в воде не растворим и не способен ее окислять даже при нагревании; по этой причине не существует «иодной воды». Но иод способен растворяться в растворах иодидов с образованием комплексных анионов:
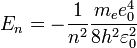 Образующийся раствор называется раствором Люголя.
Образующийся раствор называется раствором Люголя.
Йод существенно отличается по химической активности от остальных галогенов. Он не реагирует с большинством неметаллов, а с металлами медленно реагирует только при нагревании. Взаимодействие же иода с водородом происходит только при сильном нагревании, реакция является эндотермической и сильно обратимой:
Н2 + I2 = 2HI — 53 кДж.
Таким образом, химическая активность галогенов последовательно уменьшается от фтора к иоду. Каждый галоген в ряду F — At может вытеснять последующий из его соединений с водородом или металлами, то есть каждый галоген в виде простого вещества способен окислять галогенид-ион любого из последующих галогенов. Астат реагирует с металлами:
2Li+At2 = 2LiAt - астатид лития
С водородом,образуя астатоводород:
H2+At2 = 2HAt.
Астат диссоциирует не только на ионы, но и на протоны, чего нет у других галогеноводородных кислот. Межгалогенные соединения:At2+I2=2AtI-иодид астата. При электролизе водного раствора астатид лития астат выделяется на аноде: LiAt катод Li+e=Li анод 2At-2e=At2 LiOH катод Li+e=Li 4OH-4e=2H2O+O2.
Просмотров: 6851
|
|