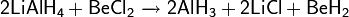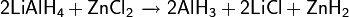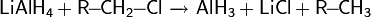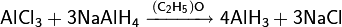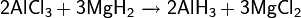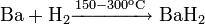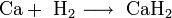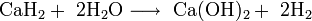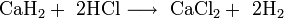Химия - Гидрид лития - Химические свойства
28 февраля 2011Оглавление:
1. Гидрид лития
2. Химические свойства
Гидрид лития относительно устойчив в сухом воздухе. Парами воды быстро гидролизуется:
При нагревании выше 850°С начинает распадаться на элементы:
Электролизом расплава также можно разложить гидрид лития на элементы, при этом водород выделяется на аноде, т.е. в расплаве происходит электролитическая диссоциация:
С кислородом и азотом начинает взаимодействовать только при нагревании и результат зависит от температуры:
Реагирует с другими неметаллами:
Восстанавливает оксиды металлов и неметаллов:
Может образовывать двойные гидриды:
Применение
Используется как осушитель, как сырье для производства алюмогидрида лития, как охладитель в ядерных реакторах. Также гидрид лития используется как легкий и портативный источник водорода для аэростатов и спасательного снаряжения.
Дейтерид лития-6
Дейтерид лития-6 LiD используется как термоядерное топливо в термоядерном оружии.
Просмотров: 2832
|
|