Химия - Гидроксид магния
28 февраля 2011Оглавление:
1. Гидроксид магния
2. Применение
неорганический гидроксид щелочноземельного металла магния. Относится к классу нерастворимых оснований.
Описание
При стандартных условиях гидроксид магния представляет собой бесцветные кристаллы с гексагональной решёткой. При температуре выше 350 °C разлагается на оксид магния и воду. Поглощает углекислый газ и воду из воздуха с образованием основного карбоната магния. Гидроксид магния практически нерастворим в воде. Является слабым основанием. Встречается в природе в виде минерала брусита.
Получение
- Взаимодействие растворимых солей магния с щелочами:
- В общем виде:
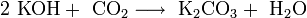
- Примеры:
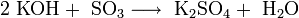

- Взаимодействие раствора хлорида магния с обожжённым доломитом:

- Взаимодействие металлического магния с парами воды:

Химические свойства
- Разложение при нагревании до 350 °C:
- Взаимодействие с кислотами с образованием соли и воды:
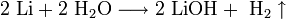
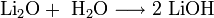
- Взаимодействие с кислотными оксидами с образованием соли и воды:

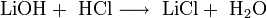
- Взаимодействие с горячими концентрированными растворами щелочей с образованием гидроксомагнезатов:
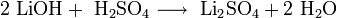
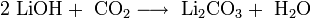
Просмотров: 3121
|
|