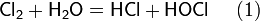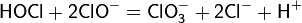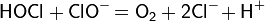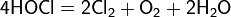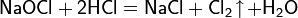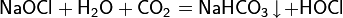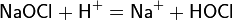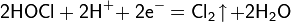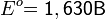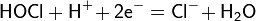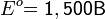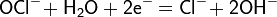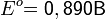Химия - Гипохлорит натрия - Химические свойства
28 февраля 2011Оглавление:
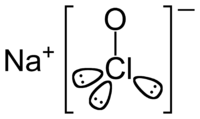
1. Гипохлорит натрия
2. История открытия
3. Физические свойства
4. Химические свойства
5. Идентификация
6. Коррозионное воздействие
7. Физиологическое действие и воздействие на окружающую среду
8. Лабораторные методы получения
9. Применение
Разложение и диспропорционирование
Гипохлорит натрия — неустойчивое соединение, легко разлагающееся с выделением кислорода:
Самопроизвольное разложение медленно происходит даже при комнатной температуре: за 40 суток пентагидрат теряет 30 % активного хлора. При температуре 70 °C разложение безводного гипохлорита протекает со взрывом.
При нагревании параллельно происходит реакция диспропорционирования:
Гидролиз и разложение в водных растворах
Растворяясь в воде, гипохлорит натрия диссоциирует на ионы:
Так как хлорноватистая кислота очень слабая, гипохлорит-ион в водной среде подвергается гидролизу:
Именно наличие хлорноватистой кислоты в водных растворах гипохлорита натрия объясняет его сильные дезинфицирующие и отбеливающие свойства.
Водные растворы гипохлорита натрия неустойчивы и со временем разлагаются даже при обычной температуре. Распад ускоряет освещение, ионы тяжёлых металлов и хлориды щелочных металлов; напротив, сульфат магния, ортоборная кислота, силикат и гидроксид натрия замедляют процесс; при этом наиболее устойчивы растворы с сильнощелочной средой.
В сильнощелочной среде, когда гидролиз гипохлорит-иона подавлен, разложение происходит следующим образом:
При температурах выше 35 °C распад сопровождается реакцией диспропорционирования:
При диапазоне pH от 5 до 10, когда концентрация хлорноватистой кислоты в растворе становится заметной, разложение идёт по следующей схеме:
В кислой среде разложение HOCl ускоряется, а в очень кислой среде при комнатной температуре наблюдается распад по следующей схеме:
Если для подкисления используется соляная кислота, в результате выделяется хлор:
Пропуская через охлаждённый водный раствор гипохлорита натрия углекислый газ, можно получить раствор хлорноватистой кислоты:
Окислительные свойства
Водный раствор гипохлорита натрия — сильный окислитель, вступающий в многочисленные реакции с разнообразными восстановителями, независимо от кислотно-щелочного характера среды.
Рассмотрим основные варианты развития окислительно-восстановительного процесса и стандартные электродные потенциалы полуреакций в водной среде:
-
- в кислой среде:
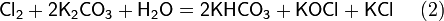 |
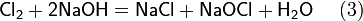 |
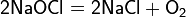 |
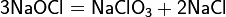 |
-
- в нейтральной и щелочной среде:
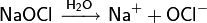 |
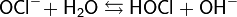 |
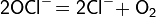 |
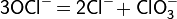 |
Некоторые окислительно-восстановительные реакции с участием гипохлорита натрия:
-
- Иодиды щелочных металлов окисляются до иода, иодата или периодата:
-
- Сульфиты окисляются в сульфаты, нитриты в нитраты, оксалаты и формиаты в карбонаты и т. п.:
-
- Фосфор и мышьяк растворяются в щелочном растворе гипохлорита натрия, образуя соли фосфорной и мышьяковой кислот:
-
- Аммиак под действием гипохлорита натрия через стадию образования хлорамина, превращается в гидразин:
- См. подробнее подраздел «Производство гидразина».
-
- Соединения металлов с низшими степенями окисления превращаются в соединения с высшими степенями окисления:
- По аналогии можно осуществить превращения: Fe → Fe → Fe; Co → Co → Co; Ni → Ni; Ru → Ru; Ce → Ce и прочие.
Просмотров: 29401
|
|