Химия - Химические реакции - Классификация
01 марта 2011Оглавление:
1. Химические реакции
2. Классификация
Существует большое количество признаков, по которым можно классифицировать химические реакции.
По фазовому составу реагирующей системы
- Гомогенные гомофазные реакции. В реакциях такого типа реакционная смесь является гомогенной, а реагенты и продукты принадлежат одной и той же фазе. Примером таких реакций могут служить реакции ионного обмена, например, нейтрализация кислоты и щелочи в растворе:
- NaOH + HCl → NaCl + H2O
- Гетерогенные гетерофазные реакции. В этом случае реагенты находятся в разном фазовом состоянии, продукты реакции также могут находиться в любом фазовом состоянии. Реакционный процесс протекает на границе раздела фаз. Примером может служить реакция солей угольной кислоты с кислотами Бренстеда:
- CO3 + 2HCl → Cl2 + CO2 + H2O
- Гетерогенные гомофазные реакции. Такие реакции протекают в пределах одной фазы, однако реакционная смесь является гетерогенной. Например, реакция образования хлорида аммония из газообразных хлороводорода и аммиака:
- NH3 + HCl → NH4Cl
- Гомогенные гетерофазные реакции. Реагенты и продукты в такой реакции существуют в пределах одной фазы, однако реакция протекает на поверхности раздела фаз. Примером таких реакций являются некоторые гетерогенно-каталитические реакции, например, реакция синтеза аммиака из водорода и азота:
- N2 + 3H2 → 2 NH3
По изменению степеней окисления реагентов
В данном случае различают
- Окислительно-восстановительные реакции, в которых атомы одного элемента восстанавливаются, то есть понижают свою степень окисления, а атомы другого элемента окисляются, то есть повышают свою степень окисления. Частным случаем окислительно-восстановительных реакций являются реакции диспропорционирования, в которых окислителем и восстановителем являются атомы одного и того же элемента, находящиеся в разных степенях окисления.
Пример окислительно-восстановительной реакции — горение водорода в кислороде с образованием воды:
- 2H2 + O2 = 2H2O
Пример реакции диспропорционирования — реакция разложения нитрата аммония при нагревании. Окислителем в данном случае выступает азот нитрогруппы, а восстановителем — азот катиона аммония:
- NH4NO3 = N2O + 2H2O
- Не окислительно-восстановительные реакции — соответственно, реакции, в которых не происходит изменения степеней окисления атомов, например, указанная выше реакция нейтрализации.
По тепловому эффекту реакции
Все реакции сопровождаются тепловыми эффектами. При разрыве химических связей в реагентах выделяется энергия, которая, в основном, идет на образование новых химических связей. В некоторых реакциях энергии этих процессов близки, и в таком случае общий тепловой эффект реакции приближается к нулю. В остальных случаях можно выделить:
- экзотермические реакции, которые идут с выделением тепла, например, указанное выше горение водорода
- эндотермические реакции в ходе которых тепло поглощается из окружающей среды.
Тепловой эффект реакции, часто имеющий очень важное значение, можно вычислить по закону Гесса, если известны энтальпии образования реагентов и продуктов. Когда сумма энтальпий продуктов меньше суммы энтальпий реагентов наблюдается выделение тепла, в противном случае — поглощение.
По типу превращений реагирующих частиц
- соединения:

- разложения:

- замещения:

- обмена:
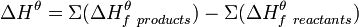
- обмена:

Химические реакции всегда сопровождаются физическими эффектами: поглощением и выделением энергии, например в виде теплопередачи, изменением агрегатного состояния реагентов, изменением окраски реакционной смеси и др. Именно по этим физическим эффектам часто судят о протекании химических реакций.
Химические процессы, протекающие в веществе, отличаются и от физических процессов, и от ядерных превращений. В физических процессах каждое из участвующих веществ сохраняет неизменным свой состав, но могут изменять внешнюю форму или агрегатное состояние.
В химических процессах получаются новые вещества с отличными от реагентов свойствами, но никогда не образуются атомы новых элементов. В атомах же участвующих в реакции элементов обязательно происходят видоизменения электронной оболочки.
В ядерных реакциях происходят изменения в атомных ядрах всех участвующих элементов, что приводит к образованию атомов новых элементов.
С помощью химических реакций можно получать практически важные вещества, которые в природе находятся в ограниченных количествах, например азотные удобрения, либо вообще не встречаются по каким-либо причинам, например сульфаниламиды и другие синтетические лекарственные препараты, полиэтилен и другие пластмассы. Химия позволяет синтезировать новые, неизвестные природе вещества, необходимые для жизнедеятельности человека. Вместе с тем, неумелое или безответственное химическое воздействие на окружающую среду и на протекающие природные процессы может привести к нарушению установившихся естественных химических циклов, что делает актуальной экологическую проблему и усложняет задачу рационального использования природных ресурсов и сохранения естественной среды обитания на Земле.
Просмотров: 5030
|
|