Химия - Химия - Основные понятия
28 февраля 2011Оглавление:
1. Химия
2. История химии
3. Основные понятия
4. Разделы химии
5. Методы физико-химического анализа
Элементарная частица
- Основная статья: Элементарная частица
Это все частицы, не являющиеся атомными ядрами или атомами. В узком смысле — частицы, которые нельзя считать состоящими из других частиц. Элементарными частицами также являются электроны и позитроны.
Атом
- Основная статья: Атом
Наименьшая частица химического элемента, обладающая всеми его свойствами. Атом состоит из ядра и «облака» электронов вокруг него. Ядро состоит из положительно заряженных протонов и нейтральных нейтронов. Взаимодействуя, атомы могут образовывать молекулы.
Атом — предел химического разложения любого вещества. Простое вещество разлагается на атомы одного вида, сложное вещество — на атомы разных видов.
Атомы неделимы химическим путём.
Молекула
Частица, состоящая из двух или более атомов, которая может самостоятельно существовать. Имеет постоянный качественный и количественный состав. Её свойства зависят от атомов, входящих в её состав, и от характера связей между ними, и от их пространственного расположения. Может иметь несколько разных состояний и переходить от одного состояния к другому под действием внешних факторов. Свойства вещества, состоящего из определённых молекул, зависят от состояния молекул и от свойств молекулы.
Вещество
- Основная статья: Вещество
В соответствии с классическими научными воззрениями различаются две физические формы существования материи — вещество и поле. Вещество — это форма материи, обладающая массой покоя. Химия изучает большей частью вещества, организованные в атомы, молекулы, ионы и радикалы. Те, в свою очередь, состоят из элементарных частиц: электронов, протонов, нейтронов и т. д.
Простые и сложные вещества. Химические элементы
Среди чистых веществ принято различать простые и сложные вещества.
Простые вещества следует отличать от понятий «атом» и «химический элемент».
это вид атомов с определённым положительным зарядом ядра. Все химические элементы указаны в Периодической системе элементов Д. И. Менделеева; каждому элементу отвечает свой порядковый номер в Периодической системе. Значение порядкового номера элемента и значение заряда ядра атома того же элемента совпадают, то есть химический элемент — это совокупность атомов с одинаковым порядковым номером.
- Основная статья: Химический элемент
Простые вещества представляют собой формы существования химических элементов в свободном виде; каждому элементу соответствует, как правило, несколько простых веществ, которые могут различаться по составу, например атомный кислород O, кислород O2 и озон O3, или по кристаллической решетке, например алмаз и графит для элемента углерод C. Очевидно, что простые вещества могут быть одно- и многоатомными.
Сложные вещества иначе называются химическими соединениями. Этот термин означает, что вещества могут быть получены с помощью химических реакций соединения из простых веществ или разделены на элементы в свободном виде с помощью химических реакций разложения.
Простые вещества представляют собой конечные формы химического разложения сложных веществ. Сложные вещества, образующиеся из простых веществ, не сохраняют химические свойства составляющих веществ.
Суммируя всё сказанное выше, можно записать:
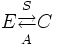 , где
, где
E — простые вещества,
C — сложные вещества,
S — синтез,
A — анализ.
В настоящее время понятия «синтез» и «анализ» химических веществ используются в более широком смысле. К синтезу относят любой химический процесс, который приводит к получению необходимого вещества и при этом существует возможность его выделения из реакционной смеси. Анализом считается любой химический процесс, позволяющий определить качественный и количественный состав вещества или смеси веществ, то есть установить, из каких элементов составлено данное вещество и каково содержание каждого элемента в этом веществе. Соответственно различают качественный и количественный анализ — две составные части одной из химических наук — аналитической химии.
Металлы и неметаллы
Все химические элементы по их свойствам, то есть свойствам свободных атомов и свойствам образуемых элементами простых и сложных веществ, делят на металлические и неметаллические элементы. Условно к неметаллам относят элементы He, Ne, Ar, Kr, Xe, Rn, F, Cl, Br, I, At, O, S, Se, Te, N, P, As, C, Si, B и H. Остальные элементы считаются металлами.
Чистые вещества и смеси веществ
Индивидуальное чистое вещество обладает определённым набором характеристических свойств. От чистых веществ следует отличать смеси веществ, которые могут состоять из двух или большего числа чистых веществ, сохраняющих присущие им свойства.
Смеси веществ делятся на гомогенные и гетерогенные.
| Агрегатное состояние составных частей | Гомогенная смесь | Гетерогенная смесь |
|---|---|---|
| Твёрдое — твёрдое | Твёрдые растворы, сплавы | Горные породы |
| Твёрдое — жидкое | Жидкие растворы | Твёрдое в жидком — суспензии или взвеси |
| Жидкое в твёрдом — жидкость в пористых телах | ||
| Твёрдое — газообразное | Хемосорбированный водород в платине, палладии, сталях | Твёрдое в газообразном — порошки, аэрозоли, в том числе дым, пыль, смог |
| Газообразное в твёрдом — пористые материалы | ||
| Жидкое — твёрдое | Твёрдые жидкости | Может принимать разную форму и фиксировать её |
| Жидкое — жидкое | Жидкие растворы | Двух- и многослойные жидкие системы, эмульсии |
| Жидкое — газообразное | Жидкие растворы | Жидкое в газообразном — аэрозоли жидкости в газе, в том числе туманы |
| Газообразное в жидком — пены | ||
| Газообразное — газообразное | Газовые растворы, напр. воздух. | Гетерогенная система невозможна |
В гомогенных смесях составные части нельзя обнаружить ни визуально, ни с помощью оптических приборов, поскольку вещества находятся в раздробленном состоянии на микроуровне. Гомогенными смесями являются смеси любых газов и истинные растворы, а также смеси некоторых жидкостей и твёрдых веществ, например сплавы.
В гетерогенных смесях либо визуально, либо с помощью оптических приборов можно различить области разных веществ, разграниченные поверхностью раздела; каждая из этих областей внутри себя гомогенна. Такие области называются фазой.
Гомогенная смесь состоит из одной фазы, гетерогенная смесь состоит из двух или большего числа фаз.
Гетерогенные смеси, в которых одна фаза в виде отдельных частиц распределена в другой, называются дисперсными системами. В таких системах различают дисперсионную среду и дисперсную фазу.
С помощью физических методов разделения можно провести разделение смесей на их составные части, то есть на чистые вещества.
| Агрегатное состояние составных частей смеси | Физическое свойство, используемое для разделения | Метод разделения |
|---|---|---|
| Твёрдое — твёрдое | Плотность | Отстаивание, седиментация |
| Смачиваемость | Флотация, пенная флотация | |
| Размер частиц | Просеивание | |
| Растворимость | Экстракция, выщелачивание | |
| Магнетизм | Магнитная сепарация | |
| Твёрдое — жидкое | Плотность | Седиментация, декантация, центрифугирование |
| Температура кипения жидкости | Выпаривание, дистилляция, осушка | |
| Размер частиц | Фильтрование | |
| Растворимость твёрдого вещества | Кристаллизация | |
| Твёрдое — газообразное | Плотность | Седиментация, центробежная сепарация |
| Размер частиц | Фильтрование | |
| Электрический заряд | Электрофильтрование | |
| Жидкое — жидкое | Плотность | Отстаивание, центрифугирование |
| Температура кипения | Дистилляция | |
| Растворимость | Экстракция | |
| Жидкое — газообразное | Плотность | Седиментация, центробежная сепарация |
| Растворимость газа | Отгонка газа, промывание с помощью другой жидкости | |
| Газообразное — газообразное | Температура конденсации | Конденсация |
| Абсорбируемость | Абсорбция | |
| Адсорбируемость | Адсорбция | |
| Размер частиц | Диффузия | |
| Масса | Центрифугирование |
Чистыми веществами называются вещества, которые при проведении физических методов не разделяются на два или более других веществ и не изменяют своих физических свойств.
В природе не существует абсолютно чистых веществ. Например, так называемый особо чистый алюминий ещё содержит 0,001 % примесей других веществ. Таким образом, абсолютно чистое вещество — это абстракция. Правда, когда речь идет о каком-либо веществе, то химия пользуется этой абстракцией, то есть считает, что вещество истинно чистое, хотя практически берется вещество с некоторым содержанием примесей. Конечно, химик должен стремиться использовать в своей практике по возможности чистые вещества, содержащие минимальное количество примесей. Следует учитывать, что даже незначительное содержание примесей может существенно изменить химические свойства вещества.
| Смесь | Сложное вещество |
|---|---|
| Образуется с помощью физического процесса | Образуется с помощью химической реакции |
| Свойства чистых веществ, из которых составлена смесь, остаются неизменными | Свойства простых веществ, из которых получено сложное вещество, в последнем не сохраняются |
| Чистые вещества могут находиться в смеси в любом массовом соотношении | Элементы, входящие в состав сложного вещества, всегда находятся в определённом массовом отношении |
| Может быть разделена на составные части с помощью физических методов | Может быть разложено на составные части только с помощью химической реакции |
Ион
Это заряженная частица, атом или молекула, которая имеет неодинаковое количество протонов и электронов. Если у частицы больше электронов, чем протонов, то она заряжена отрицательно и называется анион. Например — Cl. Если в частице электронов меньше, чем протонов, значит, она заряжена положительно и называется катион. Например — Na.
Радикал
Это частица, содержащая один или несколько неспаренных электронов. В большинстве случаев химическая связь образуется при участии двух электронов. Частица, имеющая неспаренный электрон, очень активна и легко образует связи с другими частицами. Поэтому время жизни радикала в среде, как правило, очень мало.
- См. также о свободных радикалах при радиолизе в радиобиологии.
Химическая связь
удерживает атомы или группы атомов друг около друга. Различают несколько видов химической связи: ионную, ковалентную, металлическую, водородную.
Периодический закон
Открыт Д. И. Менделеевым 1 марта 1869 года. Современная формулировка: Свойства элементов, а также образуемых ими соединений находятся в периодической зависимости от зарядов ядер их атомов.
Химические реакции
Процессы, протекающие в химическом веществе, или в смесях различных веществ, представляют собой химические реакции. При протекании химических реакций всегда образуются новые вещества.
В сущности это процесс изменения структуры молекулы. В результате реакции количество атомов в молекуле может увеличиваться, уменьшаться или оставаться постоянным. В ходе реакции изменяются связи между атомами и порядок размещения атомов в молекулах.
Химические реакции выявляют и характеризуют химические свойства данного вещества.
Исходные вещества, взятые для проведения химической реакции, называются реагентами, а новые вещества, образующиеся в результате химической реакции, — продуктами реакции. В общем виде химическая реакция изображается так:
Реагенты → Продукты
Химия изучает и описывает эти процессы как в макромасштабе, на уровне макроколичеств веществ, так и в микромасштабе, на атомно-молекулярном уровне. Внешние проявления химических процессов, протекающих в макромасштабе, нельзя непосредственно перенести на микроуровень взаимодействия веществ и однозначно их интерпретировать, однако такие переходы возможны при правильном использовании специальных химических законов, присущих только микрообласти.
Номенклатура
Это свод правил наименования химических соединений. Поскольку общее число известных соединений больше 20 млн, и их число принципиально неограниченно, необходимо пользоваться чёткими правилами при их наименовании, чтобы по названию можно было воспроизвести их структуру. Существует несколько вариантов наименования органических и неорганических соединений, но стандартом считается номенклатура IUPAC.
Просмотров: 18283
|
|