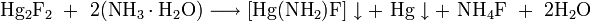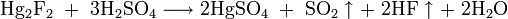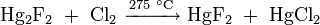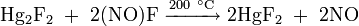Химия - Хлорид диртути(2+)
14 августа 2011Оглавление:
1. Хлорид диртути(2+)
2. Получение
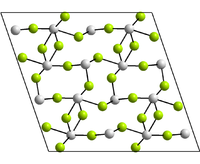
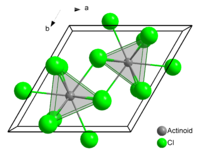
неорганическое вещество с формулой Hg2Cl2, соединение ртути и хлора. Относится к классу бинарных содинений, может рассматриваться как димер соли одновалентной ртути и соляной кислоты. Кристаллическое вещество белого цвета.
Нахождение в природе
Хлорид диртути в природе встречается в виде минерала каломели. Цвет минерала от светло-жёлтого до коричневого, твёрдость по шкале Мооса 1,5 — 2.
Физические свойства
Хлорид диртути — кристаллическое вещество белого цвета, на свету темнеет. Легколетучий, нерастворим в воде, этаноле, эфире; растворяется в бензоле, пиридине. Не образует кристаллогидратов. Возгоняется с разложением при температуре 383—400 °C
Имеет тетрагональную сингонию кристаллической решётки.
Химические свойства
Хлорид диртути не реагирует со щелочами.
Окисляется до соединений ртути:
- в горячей концентрированной серной кислоте
- в горячей концентрированной азотной кислоте
Восстанавливается до металлической ртути сильными восстановителями, например хлоридом олова в соляной кислоте:
Под действием хлора каломель окисляется с образованием сулемы:
Дисмутирует на металлическую ртуть и соединения ртути:
- в разбавленных кислотах или при нагревании выше 400 °C
- в растворе аммиака образуется так называемый белый неплавкий преципитат
При температуре возгонки в газовой фазе частично разлагается с образованием хлорида ртути:
Просмотров: 2516
|
|