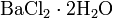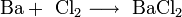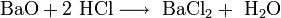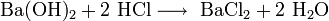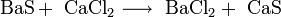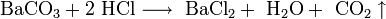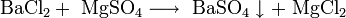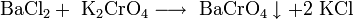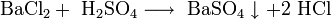Химия - Хлорид меди(II) - Получение
15 июля 2011Оглавление:
1. Хлорид меди(II)
2. Получение
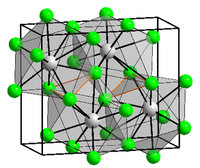
В природе дигидрат хлорида меди CuCl2·2H2O встречается в виде редкого минерала эрнохальцита.
В промышленности дихлорид меди получают:
- Хлорированием сульфида меди:
- или используют хлорирующий обжиг:
В лабораторной практике используют следующие методы:
- Взаимодействие металлической меди с хлором:
- Взаимодействие оксида меди с соляной кислотой:
- Взаимодействие гидроксида меди с соляной кислотой:
- Взаимодействие карбоната меди с соляной кислотой:
- Растворение меди в царской водке:
Химические свойства
- Взаимодействие с щелочами с образованием нерастворимого основания и растворимой соли:
- Взаимодействие с металлами, стоящими в электрохимическом ряду напряжений металлов левее меди:
- Реакции ионного обмена с другими солями:
Применение
Применяют для омеднения металлов, как катализатор крекинга, декарбоксилирования, протраву при крашении тканей.
Просмотров: 4845
|
|