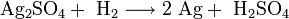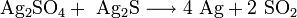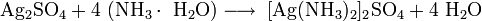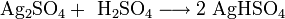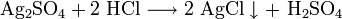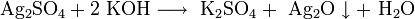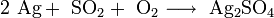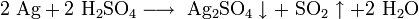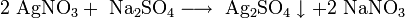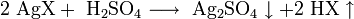Химия - Хлорид серебра(I) - Получение
15 июля 2011Оглавление:
1. Хлорид серебра(I)
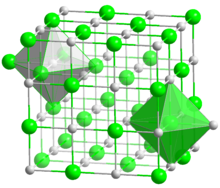
2. Физические свойства
3. Получение
4. Применение
Хлорид серебра образуется в виде белого осадка при взаимодействии растворимых солей серебра, обычно — нитрата, с хлоридами:
Химические свойства
- Разлагается при комнатной температуре под действием света:
- Образует с гидратом аммиака, тиосульфатами и цианидами щелочных металлов растворимые комплексные соединения:
- Вступает в окислительно-восстановительные реакции, восстанавливаясь до металлического серебра:
- Окислительные свойства хлорида серебра используется для извлечения металла из серебросодержащих отходов: :
- Растворяется в концентрированных растворах хлоридов и соляной кислоты, образуя комплексы:
- Медленно реагирует с концентрированной серной кислотой при кипячении:
- В растворах жидкого аммиака из-за растворимости в нём соли можно провести обменные реакции, недоступные в водных растворах:
Просмотров: 6629
|
|