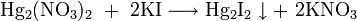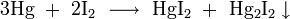Химия - Иодид меди(I) - Химические свойства
15 июля 2011Оглавление:
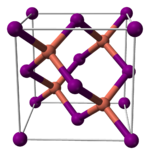
1. Иодид меди(I)
2. Химические свойства
3. Токсичность
Иодид меди не реагирует с гидратом аммика; подвергается следующим химическим превращениям:
- на свету медленно разлагается на медь и иод
- переводится в раствор с помощью реакций ионного обмена с концентрированными растворами иодоводородной кислоты, иодида калия, цианида калия, тиосульфата натрия
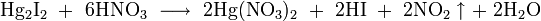 , где
, где 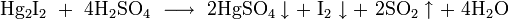
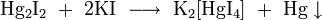
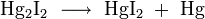
- окисляется до соединений меди и иода концентрированной азотной кислотой, горячей концентрированной серной кислотой
- в горячей концентрированной щёлочи разлагается до оксида меди
- под действием сильных восстановителей образует гидрид меди
Получение
Иодид меди может быть получен следующими способами:
- взаимодействием оксида меди с разбавленной иодоводородной кислотой
- нагреванием оксида меди с иодидом алюминия
- взаимодействием растворимых солей меди с растворимыми иодидами; образующийся в данной реакции гипотетический иодид меди мгновенно превращается в иодид меди
Просмотров: 5055
|
|