Химия - Калий - Химические свойства
01 марта 2011Оглавление:
1. Калий
2. История и происхождение названия
3. Получение
4. Химические свойства
5. Применение
6. Биологическая роль
7. Изотопы
Элементарный калий, как и другие щелочные металлы, проявляет типичные металлические свойства и очень химически активен, является сильным восстановителем. На воздухе свежий срез быстро тускнеет из-за образования плёнок соединений. При длительном контакте с атмосферой способен полностью разрушиться. С водой реагирует со взрывом. Хранить его необходимо под слоем бензина, керосина или силикона, дабы исключить контакт воздуха и воды с его поверхностью. С Na, Tl, Sn, Pb, Bi калий образует интерметаллиды.
Взаимодействие с простыми веществами
Калий при комнатной температуре реагирует с кислородом воздуха, галогенами; практически не реагирует с азотом. При умеренном нагревании реагирует с водородом с образованием гидрида:
 ,
,
с халькогенами:
 .
.
При сгорании калия на воздухе образуется надпероксид калия KO2:

В реакции с фосфором в инертной атмосфере образуется фосфид зелёного цвета:

Взаимодействие со сложными веществами
Калий при комнатной температуре активно реагирует с водой, кислотами, растворяется в жидком аммиаке с образованием тёмно-синего раствора.



Калий глубоко восстанавливает разбавленные серную и азотную кислоты:


При сплавлении металлического калия со щелочами он восстанавливает водород гидроксогруппы:

При умеренном нагревании реагирует с газообразным аммиаком с образованием амида:

Металлический калий реагирует со спиртами с образованием алкоголятов:

Алкоголяты щелочных металлов являются очень сильными основаниями и широко используются в органическом синтезе.
Соединения с кислородом
При взаимодействии калия с кислородом воздуха образуется не оксид, а пероксид и супероксид:

Оксид калия может быть получен при нагревании металла до температуры не выше 180 °C в среде, содержащей очень мало кислорода, или при нагревании смеси супероксида калия с металлическим калием:

Оксиды калия обладают ярко выраженными основными свойствами, бурно реагируют с водой, кислотами и кислотными оксидами. Практического значения они не имеют. Пероксиды представляют собой желтовато-белые порошки, которые, хорошо растворяясь в воде, образуют щёлочи и пероксид водорода:

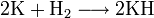
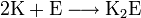

Свойство обменивать углекислый газ на кислород используется в изолирующих противогазах и на подводных лодках. В качестве поглотителя используют эквимолярную смесь супероксида калия и пероксида натрия. Если смесь не эквимолярна, то в случае избытка пероксида натрия поглотится больше газа, чем выделится, и давление в замкнутом пространстве упадёт, а в случае избытка супероксида калия выделяется больше газа, чем поглотится, и давление повысится.
В случае эквимолярной смеси объёмы поглощаемого и выделяемого газов будут равны.
Пероксиды являются сильными окислителями, поэтому их применяют для отбеливания тканей в текстильной промышленности.
Получают пероксиды прокаливанием металлов на воздухе, освобождённом от углекислого газа.
Также известен озонид калия KO3, оранжево-красного цвета. Получить его можно взаимодействием гидроксида калия с озоном при температуре не выше 20 °C:
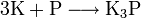
Озонид калия является очень сильным окислителем, например, окисляет элементарную серу до сульфата и дисульфата уже при 50 °C:
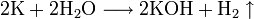
Гидроксид
Гидроксид калия представляет собой твёрдые белые непрозрачные, очень гигроскопичные кристаллы, плавящиеся при температуре 360 °C. Гидроксид калия относится к щелочам. Он хорошо растворяется в воде с выделением большого количества тепла. Растворимость едкого кали при 20 °C в 100 г воды составляет 112 г.
Просмотров: 15398
|
|