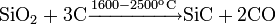Химия - Карбид кремния - Структура и свойства
28 февраля 2011Оглавление:
1. Карбид кремния
2. Формы нахождения в природе
3. Производство
4. Структура и свойства
5. Использование
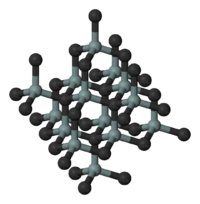
- Структуры основных политипов SiC
-

3C-SiC
-

4H-SiC
-

6H-SiC
Существует примерно 250 кристаллических форм карбида кремния. Полиморфизм SiC характеризуется большим количеством схожих кристаллических структур, называемых политипами. Они являются вариациями одного и того же химического соединения, которые идентичны в двух измерениях, но отличаются в третьем. Таким образом, их можно рассматривать как слои, сложенные в стопку в определенной последовательности .
Альфа карбид кремния является наиболее часто встречающимся полиморфом. Эта модификация образуется при температуре свыше 1700 °C и имеет гексагональную решётку, кристаллическая структура типа вюрцита.
Бета-модификация, с кристаллической структурой типа цинковой обманки, образуется при температурах ниже 1700 °C . До недавнего времени бета-форма имела сравнительно небольшое коммерческое использование, однако, в настоящее время в связи с использованием его в качестве гетерогенных катализаторов интерес к ней увеличивается.
| Политип | 3C | 4H | 6H |
|---|---|---|---|
| Кристаллическая структура | Цинковая обмана | Гексагональная | Гексагональная |
| Пространственная группа |  |
 |
 |
| Символ Пирсона |  |
 |
 |
| Постоянные решётки |  |
 |
 |
| Плотность | 3.21 | 3.21 | 3.21 |
| Ширина запрещенной зоны | 2.36 | 3.23 | 3.05 |
| МОС | 250 | 220 | 220 |
| Теплопроводность) | 3.6 | 3.7 | 4.9 |
Чистый карбид кремния бесцветен. Его оттенки от коричневого до черного цвета связаны с примесями железа. Радужный блеск кристаллов обуславливается тем, что при контакте с воздухом на их поверхности образуется плёнка из диоксида кремния, что происходит к пассивированию внешнего слоя.
Высокая температура сублимации карбидокремния делает его пригодным для создания подшипников и частей оборудования для высокотемпературных печей. Карбид кремния не плавится при любом известном давлении. Кроме того, является весьма инертным химическим веществом.
В настоящее время существует большой интерес в использовании данного вещества в качестве полупроводникового материала в электронике, где его высокая теплопроводность, высокое электрическое поле пробоя и высокая плотность электрического тока делают его перспективным материалом для высокомощных устройств . Карбид кремния имеет очень низкий коэффициент теплового расширения и он не испытывает фазовые переходы из-за которых может произойти разрушение монокристаллов.
Электропроводность
Карбид кремния является полупроводником, тип проводимости которого зависит от примесей. Проводимость n-типа получается при легировании азотом или фосфором, а p-тип — с помощью алюминия, бора, галлия или бериллия . Металлическая проводимость была достигнута за счет сильного легирования бором, алюминием и азотом. Сверхпроводимость была обнаружена в политипах 3C-SiC:Al, 3C-SiC:B и 6H-SiC:B при одинаковой температуре — 1,5 К .
Физические свойства
Является твердым, тугоплавким веществом. Кристаллическая решетка аналогична решетке алмаза. Является полупроводником.
- Стандартная энтальпия образования: −66,1
- Стандартная энергия Гиббса образования: −63,7
- Стандартная энтропия образования: 16,61
- Стандартная мольная теплоемкость: 26,86
- Характер кристаллической решётки: атомный. Энергия кристаллической решётки: 299 ккал/г·форм
Химические свойства
Карбид кремния очень устойчивое вещество и в инертной атмосфере разлагается только при очень высокой температуре:
Сильно перегретый пар разлагает карбид кремния:
Концентрированные окисляющие кислоты и их смеси растворяют карбид кремния:
В присутствии кислорода щёлочи растворяют карбид кремния:
При нагревании реагирует с кислородом:
-
- с галогенами:
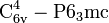
-
- с азотом, образуя нитрид кремния:
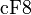
-
- с активными металлами:
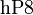
-
- и их пероксидами:
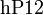
Просмотров: 15104
|
|