Химия - Кислород - Физические свойства
01 марта 2011Оглавление:
1. Кислород
2. История открытия
3. Происхождение названия
4. Получение
5. Физические свойства
6. Химические свойства
7. Применение
8. Биологическая роль кислорода
9. Изотопы
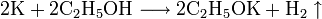
Холодная вода содержит больше растворенного O2
При нормальных условиях кислород — это газ без цвета, вкуса и запаха.
1 л его имеет массу 1,429 г. Немного тяжелее воздуха. Слабо растворяется в воде и спирте. Хорошо растворяется в расплавленном серебре. Является парамагнетиком.
При нагревании газообразного кислорода происходит его обратимая диссоциация на атомы: при 2000 °C — 0,03 %, при 2600 °C — 1 %, 4000 °C — 59 %, 6000 °C — 99,5 %.
Жидкий кислород — это бледно-голубая жидкость.
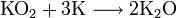
Твёрдый кислород — синие кристаллы. Известны шесть кристаллических фаз, из которых три существуют при давлении в 1 атм.:
- α-О2 — существует при температуре ниже 23,65 К; ярко-синие кристаллы относятся к моноклинной сингонии, параметры ячейки a=5,403 Å, b=3,429 Å, c=5,086 Å; β=132,53°.
- β-О2 — существует в интервале температур от 23,65 до 43,65 К; бледно-синие кристаллы имеют ромбоэдрическую решётку, параметры ячейки a=4,21 Å, α=46,25°.
- γ-О2 — существует при температурах от 43,65 до 54,21 К; бледно-синие кристаллы имеют кубическую симметрию, период решётки a=6,83 Å.
Ещё три фазы образуются при высоких давлениях:
- δ-О2 интервал температур 20-240 К и давление 6-8 ГПа, оранжевые кристаллы;
- ε-О2 давление от 10 и до 96 ГПа, цвет кристаллов от тёмно-красного до чёрного, моноклинная сингония;
- ζ-О2 давление более 96 ГПа, металлическое состояние с характерным металлическим блеском, при низких температурах переходит в сверхпроводящее состояние.
Просмотров: 13434
|
|