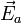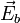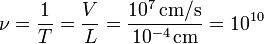Химия - Кислота - Классификация кислот
01 марта 2011Оглавление:
1. Кислота
2. Классификация кислот
3. Некоторые распространённые кислоты
4. Интересные факты
- По содержанию кислорода
- бескислородные;
- кислородосодержащие.
- По основности — количество кислых атомов водорода
- Одноосновные;
- Двухосновные;
- Трёхосновные.
- Полиосновные.
- По силе
- Сильные — диссоциируют практически полностью, константы диссоциации больше 1×10;
- Слабые — константа диссоциации меньше 1×10.
- По устойчивости
- Устойчивые;
- Неустойчивые.
- По принадлежности к классам химических соединений
- Неорганические;
- Органические;
- По летучести
- Летучие;
- Нелетучие ;
- По растворимости в воде
- Растворимые;
- Нерастворимые;
Химические свойства кислот

Окрашивание индикаторной бумаги в растворе хлороводородной кислоты
- Взаимодействие с основными оксидами с образованием соли и воды:
- Взаимодействие с амфотерными оксидами с образованием соли и воды:
- Взаимодействие со щелочами с образованием соли и воды:
- Взаимодействие с нерастворимыми основаниями с образованием соли и воды, если полученная соль растворима:
- Взаимодействие с солями, если выпадает осадок или выделяется газ:
- Сильные кислоты вытесняют более слабые из их солей:
- Металлы, стоящие в ряду активности до водорода, вытесняют его из раствора кислоты, если образующаяся соль растворима:
- С азотной кислотой и концентрированной серной кислотами реакция идёт иначе:
- См. статью Взаимодействие кислот с металлами.
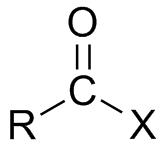
- Для органических кислот характерна реакция этерификации:
Например,
Просмотров: 8563
|
|