Химия - Константа диссоциации - Диссоциация электролитов с многовалентными ионами
01 марта 2011Оглавление:
1. Константа диссоциации
2. Диссоциация электролитов с многовалентными ионами
3. Отличие экспериментальных результатов от модели Аррениуса, вывод константы диссоциации через активности
4. Константа диссоциации сильных электролитов
В случае диссоциации электролитов с многовалентными ионами, диссоциация происходит по ступеням, причём для каждой ступени существует собственное значение константы диссоциации.
Пример: Диссоциация многоосновной кислоты:
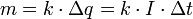
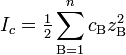
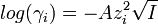
Первая степень диссоциации для таких электролитов всегда много больше последующих, что означает, что диссоциация таких соединений идёт главным образом по первой стадии.
Связь константы диссоциации и степени диссоциации
Исходя из определения степени диссоциации, для электролита КА в реакции диссоциации = = α·c, = c — α·c = c·, где α — степени диссоциации электролита.
Тогда:
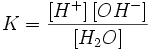 , , |
Это выражение называют законом разбавления Оствальда. При очень малых α K=cα² и
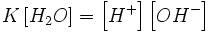 ,
,таким образом, при увеличении концентрации электролита степень диссоциации уменьшается, при уменьшении — возрастает. Подробнее связь константы диссоциации и степени диссоциации описана в статье Закон разбавления Оствальда.
Просмотров: 4311
|
|