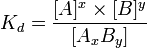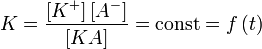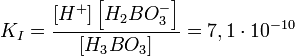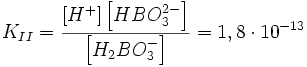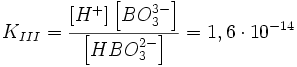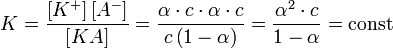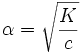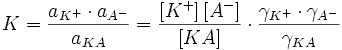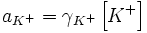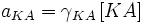Химия - Константа диссоциации - Константа диссоциации сильных электролитов
01 марта 2011Оглавление:
1. Константа диссоциации
2. Диссоциация электролитов с многовалентными ионами
3. Отличие экспериментальных результатов от модели Аррениуса, вывод константы диссоциации через активности
4. Константа диссоциации сильных электролитов
Сильные электролиты диссоциируют практически нацело, поэтому в знаменателе выражения для константы диссоциации стоит ноль, и всё выражение стремится к бесконечности. Таким образом, для сильных электролитов термин «константа диссоциации» лишён смысла.
Примеры расчётов
Диссоциация воды
Вода представляет собой слабый электролит, диссоциирующий в соответствии с уравнением
Константа диссоциации воды при 25 °C составляет
Считая, что в большинстве растворов вода находится в молекулярном виде, и учитывая, что молярная масса воды составляет 18,0153 г/моль, а плотность при температуре 25 °C — 997,07 г/л, чистой воде соответствует концентрация = 55,346 моль/л. Поэтому предыдущее уравнение можно переписать в виде
Эта величина называется ионным произведением воды. Так как для чистой воды =, можно записать
Водородный показатель воды, таким образом, равен
Диссоциация слабой кислоты
Найдём pH и степень диссоциации 0,01M раствора плавиковой кислоты HF. Её константа диссоциации равна
Обозначим степень диссоциации через α. Тогда = = Cα, = C. Подставив эти выражения в формулу для константы диссоциации, получим
Откуда следует квадратное уравнение относительно α:
Решая его по стандартной формуле, получим
Применение приближённой формулы даёт ошибку около 15 %:
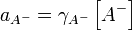
Исходя из найденного значения степени диссоциации найдём pH раствора:
Просмотров: 4313
|
|