Химия - Константа диссоциации - Отличие экспериментальных результатов от модели Аррениуса, вывод константы диссоциации через активности
01 марта 2011Оглавление:
1. Константа диссоциации
2. Диссоциация электролитов с многовалентными ионами
3. Отличие экспериментальных результатов от модели Аррениуса, вывод константы диссоциации через активности
4. Константа диссоциации сильных электролитов
Вышеприведённые выкладки базируются на теории Аррениуса, которая является слишком грубой, не учитывающей факторы электростатического взаимодействия ионов. Отклонения от идеального состояния в растворах электролитов возникают при очень малых концентрациях, так как межионные силы обратно пропорциональны квадрату расстояния между центрами ионов, в то время как межмолекулярные силы обратно пропорциональны седьмой степени расстояния, то есть межионные силы даже в разведённых растворах оказываются намного больше межмолекулярных.
Льюис показал, что для реальных растворов можно сохранить простые уравнения, если вместо концентраций ионов вводить её функцию, так называемую активность. Активность соотносится с концентрацией через поправочный коэффициент γ, называемый коэффициентом активности:
Таким образом, выражение для константы равновесия, по Аррениусу описываемое уравнением, по Льюису будет выглядеть:
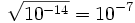 ,
,где
 ;
; ;
; .
.
В теории Льюиса связь между константой и степенью диссоциации выражается соотношением:
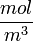
Если никаких других влияний, отклоняющих раствор от идеального состояния нет, то недиссоциированные молекулы ведут себя как идеальные газы и γKA = 1, а истинное выражение закона разбавления Оствальда примет вид:
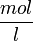 ,
,где
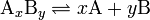 — средний коэффициент активности электролита.
— средний коэффициент активности электролита.
При c→0 и γ→1 вышеприведённое уравнение закона разбавления Оствальда принимает вид. Чем сильнее диссоциирует электролит, тем быстрее значение коэффициента активности γ отклоняется от единицы, и тем быстрее наступает нарушение классического закона разведения.
Просмотров: 4321
|
|