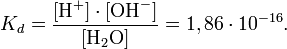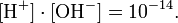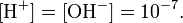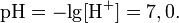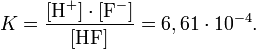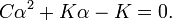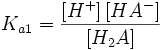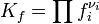Химия - Константа равновесия
28 февраля 2011Оглавление:
1. Константа равновесия
2. Константа равновесия и изменение энергии Гиббса
3. Зависимость константы равновесия от температуры
4. Методы расчета константы равновесия
величина, определяющая для данной химической реакции соотношение между термодинамическими активностями исходных веществ и продуктов в состоянии химического равновесия. Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
Способы выражения константы равновесия
Для реакции в смеси идеальных газов константа равновесия может быть выражена через равновесные парциальные давления компонентов pi по формуле:
где νi — стехиометрический коэффициент. Kp не зависит от общего давления, от исходных количеств веществ или от того, какие участники реакции были взяты в качестве исходных, но зависит от температуры .
Например, для реакции окисления монооксида углерода:
- 2CO + O2 = 2CO2
константа равновесия может быть рассчитана по уравнению:
Если реакция протекает в идеальном растворе и концентрация компонентов выражена через молярность ci, константа равновесия принимает вид:
Для реакций в смеси реальных газов или в реальном растворе вместо парциального давления и концентрации используют соответственно фугитивность fi и активность ai:
В некоторых случаях константа равновесия может являться функцией не только температуры, но и давления. Так, для реакции в смеси идеальных газов парциальное давление компонента может быть выражено по закону Дальтона через суммарное давление и мольную долю компонента, тогда легко показать, что:
где Δn — изменение числа молей веществ в ходе реакции. Видно, что Kx зависит от давления. Если число молей продуктов реакции равно числу молей исходных веществ, то Kp = Kx.
Стандартная константа равновесия
Стандартная константа равновесия реакции в смеси идеальных газов может быть рассчитана по выражению:
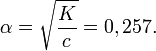
- где
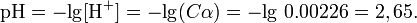 — относительные парциальные давления компонентов,
— относительные парциальные давления компонентов, 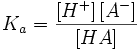 .
.
Стандартная константа равновесия — безразмерная величина. Она связана с Kp соотношением:
Видно, что если 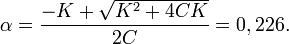 выражены в атмосферах, то
выражены в атмосферах, то 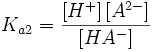 и
и 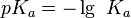 .
.
Для реакции в смеси реальных газов в стандартном начальном состоянии парциальные фугитивности газов принимаются равными их парциальным давлениям 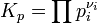 = 0,1013 МПА или 1 атм. Kf связана с K соотношением:
= 0,1013 МПА или 1 атм. Kf связана с K соотношением:
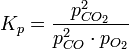
- где γi — коэффициент фугитивности i-го реального газа в смеси.
Константа равновесия реакций в гетерогенных системах
Для гетерогенной химической реакции, например, между компонентами реального газа и реального раствора, константа равновесия в общем случае может быть выражена уравнением:
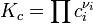
- где fi — фугитивность компонентов газовой фазы, а ak — активность компонентов конденсированной фазы.
Если конденсированные фазы представляют собой практически чистые вещества, их активности постоянны и могут быть включены в константу равновесия. Условно можно принять их равными единице и, таким образом, исключить из выражения.
Например, для реакции твёрдофазного восстановления оксида железа:
- FeOт + COг = Feт + CO2г
константа равновесия имеет вид:
Просмотров: 16479
|
|