Химия - Константа равновесия - Константа равновесия и изменение энергии Гиббса
28 февраля 2011Оглавление:
1. Константа равновесия
2. Константа равновесия и изменение энергии Гиббса
3. Зависимость константы равновесия от температуры
4. Методы расчета константы равновесия
Для реакции, протекающей в изобарно-изотермических условиях, в некотором неравновесном исходном состоянии энергии Гиббса или химические потенциалы реагирующих веществ и продуктов реакции в общем случае не одинаковы, их разность может быть рассчитана по уравнению:
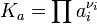
- где
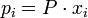 — отношение парциальных давлений участников реакции в исходном состоянии в степенях, равных их стехиометрическим коэффициентам; R — универсальная газовая постоянная.
— отношение парциальных давлений участников реакции в исходном состоянии в степенях, равных их стехиометрическим коэффициентам; R — универсальная газовая постоянная.
Это уравнение называют уравнением изотермы химической реакции. Оно позволяет рассчитать изменение энергии Гиббса при протекании процесса и определить направление протекания реакции:
- при π < Kp ΔG < 0 — реакция идёт в прямом направлении, слева направо;
- при π = Kp ΔG = 0 — реакция достигла равновесного состояния;
- при π > Kp ΔG > 0 — реакция идёт в обратном направлении.
Стандартная константа равновесия связана со стандартной энергией Гиббса реакции соотношением:
Стандартная энергия Гиббса реакции в газовой смеси — энергия Гиббса реакции при стандартных парциальных давлениях всех компонентов, равных 0,1013 МПа.
Стандартная энергия Гиббса реакции в растворе — энергия Гиббса при стандартном состоянии раствора, за которое принимают гипотетический раствор со свойствами предельно разбавленного раствора, но с концентрацией всех реагентов, равной единице. Величина стандартной энергии Гиббса реакции может быть использована для приближенной оценки термодинамической возможности протекания реакции в данном направлении, если начальные условия не сильно отличаются от стандартных. Кроме того, сравнивая величины стандартной энергии Гиббса нескольких реакций, можно выбрать наиболее предпочтительные, для которых 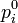 имеет наибольшую по модулю отрицательную величину.
имеет наибольшую по модулю отрицательную величину.
Просмотров: 16489
|
|