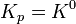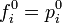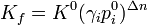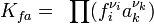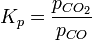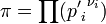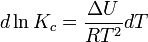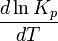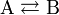Химия - Константа равновесия - Методы расчета константы равновесия
28 февраля 2011Оглавление:
1. Константа равновесия
2. Константа равновесия и изменение энергии Гиббса
3. Зависимость константы равновесия от температуры
4. Методы расчета константы равновесия
Расчётные методы определения константы равновесия реакции обычно сводятся к вычислению тем или иным способом стандартного изменения энергии Гиббса в ходе реакции, а затем использованию формулы:
При этом следует помнить, что энергия Гиббса — функция состояния системы, то есть она не зависит от пути процесса, от механизма реакции, а определяется лишь начальным и конечным состояниями системы. Следовательно, если непосредственное определение или расчёт ΔG для некоторой реакции по каким-либо причинам затруднены, можно подобрать такие промежуточные реакции, для которых ΔG известно или может быть легко определено, и суммирование которых даст рассматриваемую реакцию. В частности, в качестве таких промежуточных реакций часто используют реакции образования соединений из элементов.
Энтропийный расчёт изменения энергии Гиббса и константы равновесия реакции
Энтропийный метод расчёта ΔG реакции является одним из самых распространённых и удобных. Он основан на соотношении:
или, соответственно, для стандартного изменения энергии Гиббса:
Здесь ΔH при постоянных давлении и температуре равно тепловому эффекту реакции, методы расчёта и экспериментального определения которого известны — см., например, уравнение Кирхгофа:
Необходимо получить изменение энтропии в ходе реакции. Эта задача может быть решена несколькими способами, например:
- По термическим данным — с опорой на тепловую теорему Нернста и с использованием сведений о температурной зависимости теплоёмкости участников реакции. Например, для веществ, при нормальных условиях находящихся в твёрдом состоянии:
-
- где S0 = 0 и тогда, соответственно,
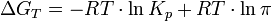 .
.
- . При некоторой заданной температуре T:
- Для жидких или газообразных при нормальной температуре веществ, или, в более общем случае, для веществ, в интервале температур от 0 и до T претерпевающих фазовый переход, следует учитывать изменение энтропии, связанное с этим фазовым переходом.
- Для идеальных газов — методами квантовой статистики.
- Различными эмпирическими и полуэмпирическими методами, для этого часто достаточно небольшого объёма исходных данных. Например, для твёрдых неорганических веществ оценить энтропию можно по формуле:
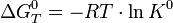
- где A и B — табличные константы, зависящие от типа рассматриваемого соединения, M — молекулярная масса.
Итак, если извеcтны 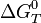 ,
, 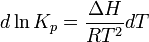 и температурные зависимости теплоёмкости,
и температурные зависимости теплоёмкости,  может быть рассчитано по формуле:
может быть рассчитано по формуле:
Несколько упрощённый вариант этой формулы получают, считая сумму теплоёмкостей веществ не зависящей от температуры и равной сумме теплоёмкостей при 298 K:
И еще более упрощённый расчёт проводят, приравнивая сумму теплоёмкостей к нулю:
Переход от  к константе равновесия осуществляется по приведённой выше формуле.
к константе равновесия осуществляется по приведённой выше формуле.
Расчёт константы равновесия методами статистической термодинамики
Экспериментальное определение константы равновесия
Просмотров: 16473
|
|