Химия - Концентрация растворов - Моляльность
01 марта 2011Оглавление:
1. Концентрация растворов
2. Объёмная доля
3. Нормальная концентрация
4. Моляльность
5. Другие способы выражения концентрации растворов
6. Формулы перехода от одних выражений концентраций растворов к другим
7. Наиболее распространённые единицы
Моляльность — количество растворённого вещества в 1000 г растворителя. Измеряется в молях на кг, также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/кг называют 0,5-моляльным.
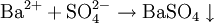 ,
,
где:
- ν — количество растворённого вещества, моль;
- m2 — масса растворителя, кг.
Следует обратить особое внимание, что несмотря на сходство названий, молярная концентрация и моляльность — величины различные. Прежде всего, в отличие от молярной концентрации, при выражении концентрации в моляльности расчёт ведут на массу растворителя, а не на объём раствора. Моляльность, в отличие от молярной концентрации, не зависит от температуры.
Титр раствора
Титр раствора — масса растворённого вещества в 1 мл раствора.
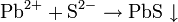 ,
,
где:
- m1 — масса растворённого вещества, г;
- V — общий объём раствора, мл;
В аналитической химии обычно концентрацию титранта пересчитывают применительно к конкретной реакции титрования таким образом, чтобы объём использованного титранта непосредственного показывал массу определяемого вещества; то есть титр раствора показывает, какой массе определяемого вещества соответствует 1 мл титрованного раствора.
Просмотров: 11912
|
|