Химия - Концентрация растворов - Нормальная концентрация
01 марта 2011Оглавление:
1. Концентрация растворов
2. Объёмная доля
3. Нормальная концентрация
4. Моляльность
5. Другие способы выражения концентрации растворов
6. Формулы перехода от одних выражений концентраций растворов к другим
7. Наиболее распространённые единицы
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль-экв/л или г-экв/л. Для записи концентрации таких растворов используют сокращения «н» или «N». Например, раствор содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.
 ,
,
где:
- ν — количество растворённого вещества, моль;
- V — общий объём раствора, л;
- z — число эквивалентности.
Нормальная концентрация может отличаться в зависимости от реакции, в которой участвует вещество. Например, одномолярный раствор H2SO4 будет однонормальным, если он предназначается для реакции со щёлочью с образованием гидросульфата KHSO4, и двухнормальным в реакции с образованием K2SO4.
Мольная доля
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы.
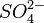 ,
,
где:
- νi — количество i-го компонента, моль;
- n — число компонентов;
Просмотров: 11904
|
|