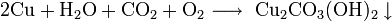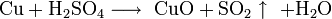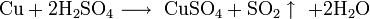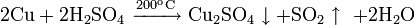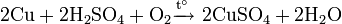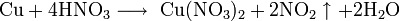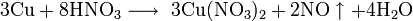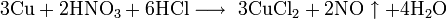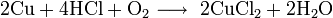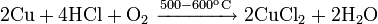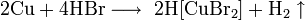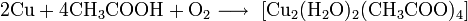Химия - Медь - Физические свойства
28 февраля 2011Оглавление:
1. Медь
2. История и происхождение названия
3. Нахождение в природе
4. Физические свойства
5. Применение
6. Биологическая роль
7. Производство, добыча и запасы меди
8. Интересные факты
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Медь образует кубическую гранецентрированную решётку, пространственная группа F m3m, a = 0,36150 нм, Z = 4.
Медь обладает высокой тепло- и электропроводностью. Имеет два стабильных изотопа — Cu и Cu, и несколько радиоактивных изотопов. Самый долгоживущий из них, Cu, имеет период полураспада 12,7 ч и два варианта распада с различными продуктами.
Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем, баббиты — со свинцом и другие.
Химические свойства
Не изменяется на воздухе в отсутствие влаги и диоксида углерода. Является слабым восстановителем, не реагирует с водой, разбавленной соляной кислотой. Переводится в раствор кислотами-неокислителями или гидратом аммиака в присутствии кислорода, цианидом калия. Окисляется концентрированными серной и азотной кислотами, «царской водкой», кислородом, галогенами, халькогенами, оксидами неметаллов. Реагирует при нагревании с галогеноводородами.
На влажном воздухе медь окисляется, образуя основный карбонат меди:
Реагирует с концентрированной холодной серной кислотой:
С концентрированной горячей серной кислотой:
С безводной серной кислотой при 200 °C:
C разбавленной серной кислотой при нагревании в присутствии кислорода воздуха:
Реагирует с концентрированной азотной кислотой:
С разбавленной азотной кислотой:
С царской водкой:
C разбавленной хлороводородной кислотой в присутствии кислорода:
С газообразным хлороводородом при 500—600 °C:
С бромоводородом:
Также медь реагирует с концентрированной уксусной кислотой в присутствии кислорода:
Медь растворяется в концентрированном гидроксиде аммония, с образованием аммиакатов:
Окисляется до оксида меди при недостатке кислорода и 200 °C и до оксида меди, при избытке кислорода и температурах порядка 400—500 °C:
Медный порошок реагирует с хлором, серой и бромом, при комнатной температуре:
При 300—400 °C реагирует с серой и селеном:
C оксидами неметаллов:
Медь реагирует с цианидом калия с образованием дицианокупрата калия, щелочи и водорода:
С концентрированной соляной кислотой и хлоратом калия:
Соединения

В соединениях медь бывает двух степеней окисления: менее стабильную степень Cu и намного более стабильную Cu, которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu2, полученных в 1994 году.
Карбонат меди имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди. Сульфат меди при гидратации даёт синие кристаллы медного купороса CuSO4∙5H2O, используется как фунгицид. Также существует нестабильный сульфат меди Существует два стабильных оксида меди — оксид меди Cu2O и оксид меди CuO. Оксиды меди используются для получения оксида иттрия бария меди, который является основой для получения сверхпроводников. Хлорид меди — бесцветные кристаллы плотностью 4,11 г/см³. В сухом состоянии устойчив. В присутствии влаги легко окисляется кислородом воздуха, приобретая сине-зелёную окраску. Может быть синтезирован восстановлением хлорида меди сульфитом натрия в водном растворе.
Соединения меди
Многие соединения меди имеют белую окраску либо бесцветны. Это объясняется тем, что в ионе меди все пять Зd-орбиталей заполнены парами электронов. Однако оксид Cu2O имеет красновато-коричневую окраску. Ионы меди в водном растворе неустойчивы и легко подвергаются диспропорционированию:
2Cu → Cu + Cu
В то же время медь встречается в форме соединений, которые не растворяются в воде, либо в составе комплексов. Например, дихлорокупрат-ион устойчив. Его можно получить, добавляя концентрированную соляную кислоту к хлориду меди:
CuCl + Cl →
Хлорид меди — белое нерастворимое твёрдое вещество. Как и другие галогениды меди, он имеет ковалентный характер и более устойчив, чем галогенид меди. Хлорид меди можно получить при сильном нагревании хлорида меди:
2CuCl2 → 2CuCl + Cl2

Образует неустойчивый комплекс с CO
CuCl+CO → CuCl разлагающийся при нагревании
Другой способ его получения заключается в кипячении смеси хлорида меди с медью в концентрированной соляной кислоте. В этом случае сначала образуется промежуточное соединение — комплексный дихлорокупрат-ион. При выливании раствора, содержащего этот ион, в воду происходит осаждение хлорида меди. Хлорид меди реагирует с концентрированным раствором аммиака, образуя комплекс диамминмеди. Этот комплекс не имеет окраски в отсутствие кислорода, но в результате реакции с кислородом превращается в синее соединение.
Соединения меди
Степень окисления II — наиболее стабильная степень окисления меди. Соли меди образуются при растворении меди в кислотах-окислителях. Большинство солей в этой степени окисления имеют синюю или зелёную окраску.
Соединения меди обладают слабыми окислительными свойствами, что используется в анализе.
Соединения меди и меди
Степени окисления III и IV являются малоустойчивыми степенями окисления и представлены только соединениями с кислородом, фтором или в виде комплексов.
Аналитическая химия меди
- Традиционно количественное выделение меди из слабокислых растворов проводилось с помощью сероводорода.
- В растворах, при отсутствии мешающих ионов медь может быть определена комплексонометрически или потенциометрически, ионометрически.
- Микроколичества меди в растворах определяют кинетическими методами.
Просмотров: 28540
|
|