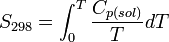Химия - Монослой
01 марта 2011Оглавление:
1. Монослой
2. Биология
3. Мономолекулярный слой
Химия
Монослой Ленгмюра или нерастворимый монослой — это нерастворимый слой толщиной в одну молекулу органического материала, распространённый в водной фазе. Обычно для приготовления монослоёв Ленгмюра используются амфифильные материалы, которые достигают гидрофильной группы и гидрофильного хвоста. Начиная с 1980-х монослои Ленгмюра были получены из множества других материалов, включая макромолекулы, такие как полимеры. Монослои Ленгмюра широко изучаются для производства плёнок Ленгмюра-Блоджетт, которые формируются размещением монослоёв на твёрдых подложках.
Монослой Гиббса или растворимый монослой — это монослой, формируемый на смеси, которая растворяется в одной из фаз, разделяемых поверхностью, на которой формируется монослой.
Время формирования
Время формирования монослоя — промежуток времени, который в среднем требуется на покрытие поверхности адсорбатом, к примеру кислородом. Если адсорбат имеет коэффициент прилипания равный 1, то время формирования монослоя описывается формулой:
где t — это время в секундах, а P — давление в паскалях. Для того, чтобы покрыть поверхность при давлении 300 µPa требуется всего одна секунда.
Фазы монослоя и уравнения состояния
Монослой Ленгмюра может быть сжат или расширен путём изменения его области сдвигом барьера в сбалансированной плёнке Ленгмюра. Если поверхностное натяжение границы раздела измеряется путём сжатия, получается «изотерма сжатия». Эта изотерма демонстрирует изменение поверхностного давления на поверхности. Это является аналогичным трёхмёрному процессу, где давление изменяется в зависимости от объёма.
Разнообразие бипространственных фаз может быть обнаружено через разделение фазовыми переходами. В течение фазового перехода поверхностное натяжение не меняется, но изменяется площадь, так же как и в нормальных фазовых переходах изменяется объём, а давление остаётся постоянным.
Двумерные фазы, в порядке увеличения давления:
- Двумерный газ: существует несколько молекул, слабо взаимодействующих между собой; таким образом может быть использован аналог уравнения состояния для трёхмерных газов: закон идеального газа ΠA = RT, где A — область одного моля. По мере увеличения давления необходимо применение более сложных уравнений
- Расширенные жидкости
- Сжатые жидкости
- Твёрдые тела
Если поверхность сократить еще, то происходит коллапс, монослой разрушается и формируются растворимые агрегаты и мультислои.
Монослой Гиббса также может быть описан уравнениями состояния, которые могут быть получены из изотермы Гиббса.
- Для очень разбавленных растворов γ = γo − mC,
через изотерму Гиббса достигается другая аналогия идеального газа Π = ΓRT
- Для более концентрированных растворов применяется изотерма Ленгмюра
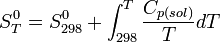 , тогда
, тогда 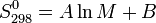
Просмотров: 3003
|
|