Химия - Неорганические кислоты
28 февраля 2011Оглавление:
1. Неорганические кислоты
2. Характеристики кислот
3. Общие методы получения кислот
неорганические вещества, молекулы которых при электролитической диссоциации в водной среде отщепляют протоны, в результате чего в растворе образуются гидроксоний-катионы Н3О и анионы кислотных остатков А:
- НА + Н2O ↔ Н3О + А
, в результате чего в водном растворе создается избыток гидроксоний-катионов:
- H3BO3 + 2Н2O ↔ + H3O
Число отщепляемых от молекулы кислоты протонов называется основностью кислоты. Теории кислот и оснований кроме указанных выше относят к кислотам многие ионные соединения. Общее свойство кислот — способность реагировать с основаниями и основными оксидами с образованием солей, например:
- HNO3 + NaOH → NaNO3 + H2O
- 2HCl + CaO → CaCl2 + H2O
Классификация кислот
Кислоты неорганические подразделяют на кислородсодержащие общей формулы НnЭОm, где Э — кислотообразующий элемент, и бескислородные HnХ, где Х — галоген, халькоген или неорганический бескислородный радикал. Оксокислоты характерны для многих химических элементов, особенно для элементов в высоких степенях окисления.
Атомы Н в оксокислотах обычно связаны с кислородом. Если в оксокислоте имеются атомы Н, не связанные с кислородом, то они не отщепляются в водном растворе с образованием Н3O и не принимают участия в реакции кислот с основаниями. Некоторые кислоты известны в двух таутомерных формах, различающихся положением атома Н, например.:
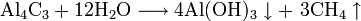
Молекулы многих кислот содержат более одного атома кислотообразующего элемента Э. Очень многочисленны изополикислоты, содержащие атомы Э, связанные через атом кислорода, причем фрагменты -Э-О-Э- могут образовать как открытые цепи, так и циклические структуры. В некоторых кислотах содержатся цепи из одинаковых атомов, например, цепи -S-S- в политионовых кислотах H2SnO6 или сульфанах H2Sn. Известны гетерополикислоты, имеющие фрагменты -Э-О-Э'-, где Э и Э'-атомы двух разных элементов, например: H4×14H2O. Существует множество комплексных кислот, например: H2, H, H4. Кислоты аналогичные оксокислотам, но содержащие вместо атома кислорода серу, называются тиокислотами, например Н2S2O3, Н3AsS3. Пероксокислоты, например H2S2O8, имеют пероксогруппы -О-О-.
Константу равновесия реакции называют константой кислотности Ka. Многоосновные кислоты диссоциируют ступенчато, каждой ступени отвечает своя Кa, причем всегда Ka"Ka ориентировочно каждая последующая Ka меньше предыдущей на 5 порядков. По значению рК1 = -lgKa Неорганические кислоты подразделяют на очень слабые, слабые, средней силы, сильные, очень сильные. Согласно правилу Полинга, для очень слабых оксокислот НnЭOm разность m — n = 0, для слабых, сильных и очень сильных эта разность составляет соответственно 1, 2 и 3. Данная закономерность обусловлена сдвигом электронной плотности от связи Н-О к связям Э = O и делокализацией электронной плотности в анионе.
Просмотров: 4152
|
|