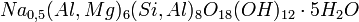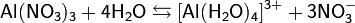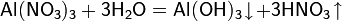Химия - Нитрат алюминия - Химические свойства
28 февраля 2011Оглавление:
1. Нитрат алюминия
2. Химические свойства
3. Применение
- При растворении в воде подвергается гидролизу:
- Водные растворы нитрата алюминия имеют pH от 2,5 до 3,7.
- При нагревании гидролиз можно провести полностью:
- Вступает в реакцию со щелочами:
- Реакция с концентрированным водным раствором аммиака может идти по двум направлениям.
- На холоду:

- При нагревании:
- При нагревании разлагается :
- Нонагидрат при сильном нагревании сперва образует основную соль Al2NO3•1,5H2O, а при более высокой температуре разлагается до аморфного оксида алюминия.
- Нитрат алюминия является сильным окислителем — его безводная форма со взрывом реагирует со многими органическими растворителями.
Получение
Лабораторные методы
В лаборатории водный раствор нитрата алюминия получают растворением алюминия в разбавленной азотной кислоте:
Альтернативный метод заключается во взаимодействии гидроксида алюминия с азотной кислотой:
Наконец, искомую соль можно получить обменной реакцией сульфата алюминия с нитратом бария или свинца:
Из водного раствора посредством кристаллизации выделяют нонагидрат нитрата алюминия. Кристаллогидраты с меньшим количеством воды получают из водных растворов азотной кислоты.
Безводный нитрат алюминия можно получить реакцией кристаллогидрата с избытком оксидом азота) или безводного хлорида алюминия с нитратом хлора):
Промышленное производство
В промышленности безводный нитрат алюминия получают взаимодействием оксида или гидроксида алюминия с оксидом азота:
В случае использования бромида алюминия в качестве исходного сырья для синтеза, реакция идёт в две стадии:
Просмотров: 5357
|
|