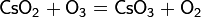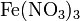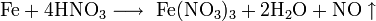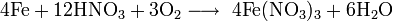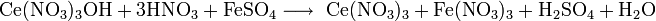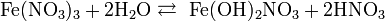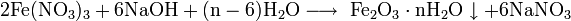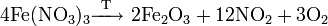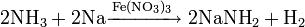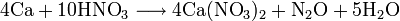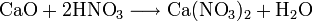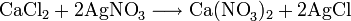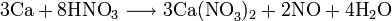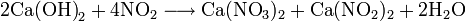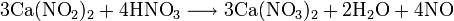Химия - Нитрат кальция - Получение
28 февраля 2011Оглавление:
1. Нитрат кальция
2. Получение
Получают кальция нитрат действием HNO3 на известняк или поглощением нитрозных газов известковым молоком. Применяют кальция нитрат как азотное удобрение и для получения особо чистого СаО.
Для получения гранулированной кальциевой селитры используется способ низкотемпературной нейтрализации азотной кислоты природным известняком или продуктами переработки известняка.
Реакции с получением нитрата кальция
Нитрат кальция производится путем обработки известняка с азотной кислотой, после нейтрализации аммиака:
- CaCO3 + 2HNO3 → Ca2 + CO2 + H2O.
Он также является побочным продуктом процесса Оддо при добыче фосфата кальция:
- Ca32 + 6HNO3 + 12H2O2 → H3PO4 + 3Ca2 + 12H2O.
Так же как и нитраты щелочноземельных металлов, кальциевая селитра при нагревании разлагается на выпуске двуокиси азота:
- 2Ca2 → 2CaO + 4NO2 + O2, ΔH°обр.=369 кДж/моль
Также нитрат кальция можно получить проделав следующие реакции:
Также образование нитрата кальция возможно и за счет атмосферных явлений:
Просмотров: 4241
|
|