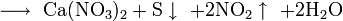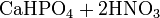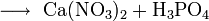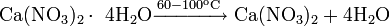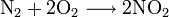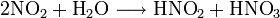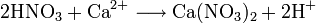Химия - Нитрат меди(II) - Химические свойства
15 июля 2011Оглавление:
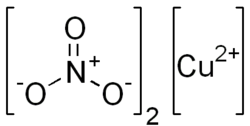
1. Нитрат меди(II)
2. Химические свойства
3. Получение
Разложение
Нитрат меди при нагревании разлагается с образованием оксида меди и диоксида азота:
Образовавшийся диоксид азота можно использовать для лабораторного получения азотной кислоты:
Гидролиз
Нитрат меди в водном растворе диссоциирует на ионы с одновременной гидратацией катиона:
Катион тетрааквамеди подвергается обратимому гидролизу:
В упрощённом виде:
Обменные реакции
В водных растворах нитрат меди вступает в реакции ионного обмена, характерные для растворимых солей двухвалентной меди, например:
с щёлочью
с фосфатом натрия
с жёлтой кровяной солью
с концентрированным раствором аммиака
с азидами щелочных металлов)
Прочие реакции
Нитрат меди реагирует с растворами гидроксиламина и гидразина с выпадением белого осадка азида меди:
Нитрат меди реагирует с жидким тетраоксидом диазота с выпадением темно-зелёного осадка:
Просмотров: 7736
|
|