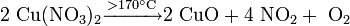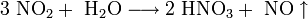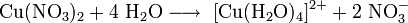Химия - Нитрат меди(II) - Получение
15 июля 2011Оглавление:
1. Нитрат меди(II)
2. Химические свойства
3. Получение
Нитрат меди может быть получен растворением в азотной кислоте металлической меди, оксида меди или гидроксида меди:
Безводный нитрат меди может быть получен при взаимодействии меди с тетраоксидом диазота:
Применение
Нитрат меди используют для получения чистого оксида меди, медьсодержащих катализаторов, как фунгицид, протраву при крашении тканей.
В сочетании с уксусным ангидридом используется в органическом синтезе в качестве реагента для нитрования ароматических соединений.
Токсичность
Нитрат меди является умеренно-токсичным веществом — LD50 для крыс перорально 950 мг/кг.
При контакте с кожей и слизистыми оболочками вызывает раздражение, при попадании в глаза — сильное раздражение с риском помутнения роговицы.
Представляет опасность для окружающей среды — LC50 для рыб 0,29 мг/л в течение 96 ч.
Просмотров: 7746
|
|