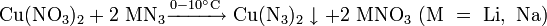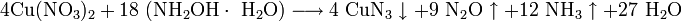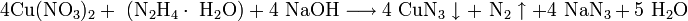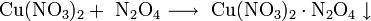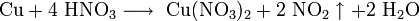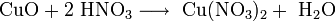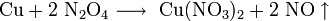Химия - Нитрат свинца(II) - Получение
15 июля 2011Оглавление:
1. Нитрат свинца(II)
2. Физические свойства
3. Получение
4. Применение
5. Меры предосторожности
Динитрат свинца не встречается в природе. Промышленные и лабораторные методы его получения сводятся к растворению в разбавленной азотной кислоте свинца, его оксида или гидроксида:
кислоту берут с избытком для подавления гидролиза и снижения растворимости нитрата свинца.
При очистке азотной кислотой отходов, содержащих свинец, например, при обработке свинцово-висмутных отходов на заводах, образуется динитрат свинца как побочный продукт. Эти соединения используются в процессе цианирования золота.
Химические свойства
Динитрат свинца хорошо растворяется в воде, давая бесцветный раствор. Растворимость сильно увеличивается при нагревании:
| Растворимость в воде, г/100 г | 45,5 | 52,2 | 58,5 | 91,6 | 116,4 |
| Температура, °C | 10 | 20 | 25 | 60 | 80 |
Водный раствор диссоциирует на катионы свинца и нитрат-анионы:
Раствор нитрата свинца подвергается гидролизу и имеет слабокислую реакцию, которая имеет показатель рН от 3,0 до 4,0 для 20 % водного раствора. При избытке ионов NO3 в растворе образуются нитратокомплексы, и. При повышении pH раствора образуются гидроксонитраты переменного состава Pbxy, некоторые из них выделены в твёрдом состоянии.
Так как только динитрат и ацетат свинца являются растворимыми соединениями свинца, то все остальные соединения можно получить обменными реакциями:
Любое соединение, содержащее катион свинца, будет реагировать с раствором, содержащим йодид анион с образованием осадка оранжево-желтого цвета). Из-за разительной перемены цвета эта реакция часто используется для демонстрации под названием золотой дождь:
Аналогичная реакция обмена проходит и в твердой фазе. Например, при смешении бесцветных йодида калия и динитрата свинца, и сильного измельчения, например, перетиранием в ступе, происходит реакция:
Цвет полученной смеси будет зависеть от относительного количества использованных реагентов и степени измельчения.
При растворении нитрата свинца в пиридине или жидком аммиаке образуются продукты присоединения, например Pb2·4C5H5N и Pb2·n NH3, где n=1, 3, 6.
Динитрат свинца является окислителем. В зависимости от типа реакции он может быть как Pb-ион, который имеет стандартный редокс-потенциал −0.125 V, или нитрат-ион, который в кислой среде имеет +0.956 V .
При нагревании кристаллов динитрата свинца они начинают разлагаться на диоксид свинца, кислород и диоксид азота, процесс сопровождается характерным треском. Этот эффект называется декрепитация:
Благодаря этому свойству нитрат свинца иногда используется в пиротехнике.
Просмотров: 8568
|
|