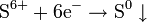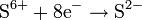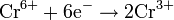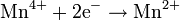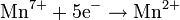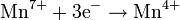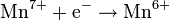Химия - Нитрит аммония
28 февраля 2011Получение
Восстановлением свежевыделенным водородом нитрата аммония из слабо кислых растворов:
Поглощение смеси газообразных окислов NO и NO2 водным раствором аммиака:
Обменными реакциями:
Химические свойства
Аммония нитрит неустойчивое вещество и при нагревании разлагается:
при резком нагревании возможен взрывной характер разложения.
Как соль слабого основания и слабой кислоты разлагается кислотами и щелочами:
Окисляется кислородом воздуха:
Применение
Нитрит аммония используется в качестве родентицида, дезинфектора и сельскохозяйственного пестицида. Токсин для человека и водных организмов.
Просмотров: 2212
|
|