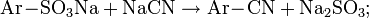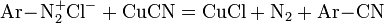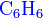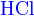Химия - Нитронаты
28 февраля 2011Оглавление:
1. Нитронаты
2. Химические свойства
Нитронаты — органические соединения, в которых присутствует функциональная группа =N, представляющая собой таутомерную форму нитро-группы −NO2. Общая формула нитронатов R1R2C=N. Если X = H, нитронаты, обычно, называют нитроновыми кислотами; существуют также нитроновые соли, нитроновые эфиры и т.д.

Общая структура нитронатов
По сути, нитронаты являются аци-формой первичных и вторичных нитросоединений:
Получение
Существует несколько общих способов получения нитронатов:
- алкилирование нитросоединений диазометаном и его производными:
- где X: −NO2, −CN, −COOCH3, −COCH3, −C6H5 и прочие электронно-донорные группы.
- алкилирование нитросоединений оксониевыми солями:
- взаимодействие вторичных нитросоединений с сильными электрофильными реагентами:
- синтез через серебряную соль тринитрометана:
- синтез с использованием триалкилсилильных производных:
Просмотров: 2545
|
|