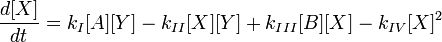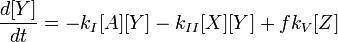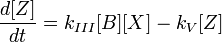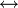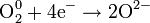Химия - Окислитель
28 февраля 2011Оглавление:
1. Окислитель
2. Мнемонические правила
вещество, в состав которого входят атомы, присоединяющие во время химической реакции электроны, иными словами, окислитель — это акцептор электронов.
В зависимости от поставленной задачи в качестве окислителя могут быть использованы самые разные вещества.
- Электрохимическое окисление позволяет окислять практически любые вещества на аноде, в растворах или в расплавах. Так, самый сильный неорганический окислитель, элементарный фтор, получают электролизом расплавов фторидов.
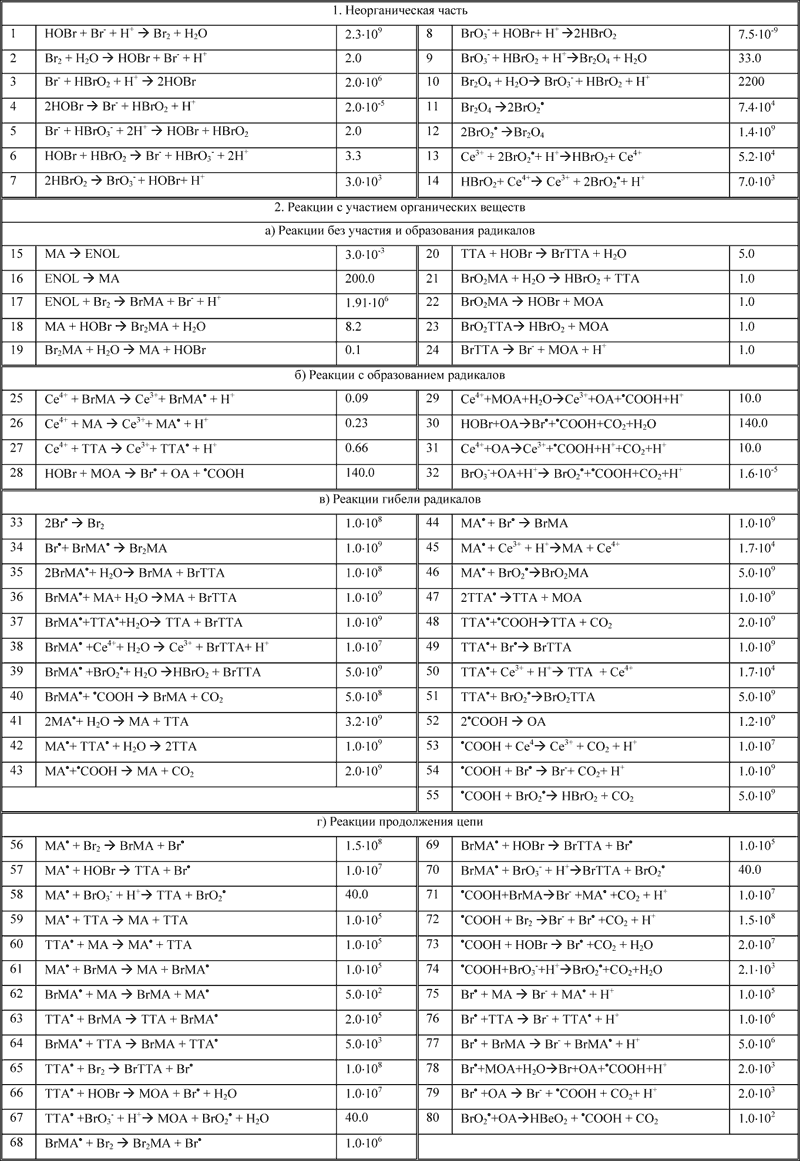
Распространённые окислители и их продукты
| Окислитель | Полуреакции | Продукт | Стандартный потенциал, В |
|---|---|---|---|
| O2 кислород |  |
Разные, включая оксиды, H2O и CO2 | +1,229 +0,401 |
| O3 озон | Разные, включая кетоны и альдегиды | ||
| Пероксиды |  |
Разные, включая оксиды, окисляет сульфиды металлов до сульфатов H2O | |
| Hal2 галогены |  |
Halокисляет металлы, P, C, S, Si до галогенидов | F2: +2,87 Cl2: +1,36 |
| ClO гипохлориты | Cl | ||
| ClO3 хлораты | Cl | ||
| HNO3 азотная кислота | с активными металлами, разбавленная
с активными металлами, концентрированная
с тяжёлыми металлами, разбавленная
c тяжёлыми металлами, концентрированная
|
NH3, NH4
NO2 |
|
| H2SO4, конц. серная кислота | c неметаллами и тяжёлыми металлами
с активными металлами
|
SO2 окисляет металлы до сульфатов с выделением сернистого газа или серы S
|
|
| Шестивалентный хром |  |
Cr | +1,33 |
| MnO2 оксид марганца |  |
Mn | +1,23 |
| MnO4 перманганаты | кислая среда
нейтральная среда
сильнощелочная среда
|
Mn
|
+1,51
|
| Катионы металлов и H | 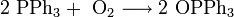
|
Me
H2 |
См. Электрохимический ряд активности металлов |
Просмотров: 2790
|
|