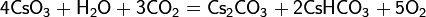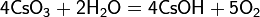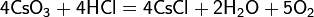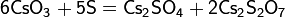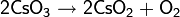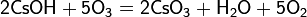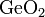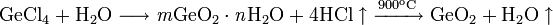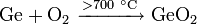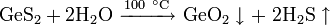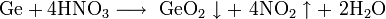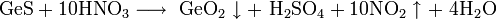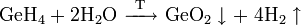Химия - Оксид германия(IV) - Получение
02 июля 2011Оглавление:
1. Оксид германия(IV)
2. Получение
3. Применение
4. Токсичность
Получают двуокись германия гидролизом GeCl4 с последующей просушкой и прокаливанием осадка при 900 °C. При этом обычно образуется смесь аморфного и гексагонального GeO2.
При температуре выше 700 °C при помощи окисления германия получается двуокись германия:
Гидролизом сульфид германия в кипящей воде:
Растворяя германий в разбавленной азотной кислоте:
Окислением сульфида германия концентрированной горячей азотной кислотой:
Гидролизом или окислением германоводородов:
Разрушение германатов разбавленной азотной кислотой:
Химические свойства
α-GeO2 и аморфный GeO2 химически более пассивны, поэтому химические свойства описывают для β-GeO2.
Нагревание диоксида германия при температуре 1000 °C дает оксид германия :
Восстанавливается водородом и углеродом до металлического германия при нагревании:
Диоксид германия растворяется в воде, образуя слабую метагерманиевую кислоту:
Растворяется в щелочах, с разбавленными образует соли метагерманиевой кислоты, с концентрированными — ортогерманиевой:
Серый нитрид германия может быть получен действием NH3 на металлический германий при 700 °C:
Взаимодействует с галогеноводородами:
При нагревании разрушает соли более слабых кислот с образованием германатов:
С окислами щелочных металлов, в зависимости от их количества, образует различные германаты:
Просмотров: 5578
|
|