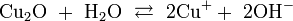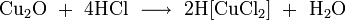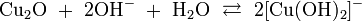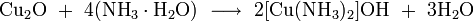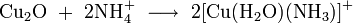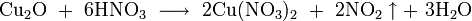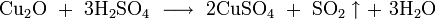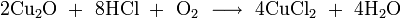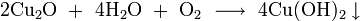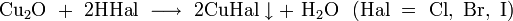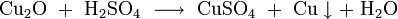Химия - Оксид меди(I) - Химические свойства
15 июля 2011Оглавление:
1. Оксид меди(I)
2. Химические свойства
3. Получение
4. Применение
Реакции в водных растворах
Оксид меди не реагирует с водой. В очень малой степени диссоциирует:
Оксид меди переводится в раствор:
- концентрированной соляной кислотой
- концентрированной щёлочью
- концентрированным гидратом аммиака и концентрированными растворами солей аммония
- путём окисления до солей меди различными окислителями
Также оксид меди вступает в водных растворах в следующие реакции:
- медленно окисляется кислородом до гидроксида меди
- реагирует с разбавленными галогенводородными кислотами с образованием соответствующих галогенидов меди:
- в разбавленной серной кислоте дисмутирует на сульфат меди и металлическую медь
- восстанавливается до металлической меди типичными восстановителями, например гидросульфитом натрия в концентрированном растворе
Реакции при высоких температурах
Оксид меди восстанавливается до металлической меди в следующих реакциях:
- при нагревании до 1800 °C
- при нагревании в токе водорода, монооксида углерода, с алюминием
- при нагревании с серой
Оксид меди может быть окислен до соединений меди в токе кислорода или хлора:
Также, при высоких температурах оксид меди реагирует:
- с аммиаком)
- c оксидами щелочных металлов и бария
Прочие реакции
Оксид меди реагирует с азидоводородом:
- при охлаждении выпадает осадок азида меди
- при комнатной температуре в токе азота выпадает осадок азида меди
Просмотров: 8106
|
|