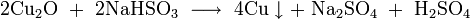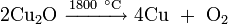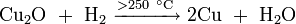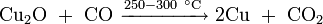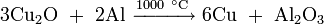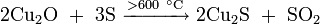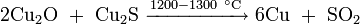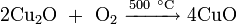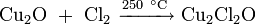Химия - Оксид меди(I) - Получение
15 июля 2011Оглавление:
1. Оксид меди(I)
2. Химические свойства
3. Получение
4. Применение
Оксид меди может быть получен:
- нагреванием металлической меди при недостатке кислорода
- нагреванием металлической меди в токе оксида азота или оксида азота
- нагреванием металлической меди с оксидом меди
- термическим разложением оксида меди
- нагреванием сульфида меди в токе кислорода
В лабораторных условиях оксид меди может быть получен восстановлением гидроксида меди:
Также, оксид меди образуется в реакциях ионного обмена солей меди с щелочами, например:
- в реакции иодида меди с горячим концетрированным раствором гидроксида калия
- в реакции дихлорокупрата водорода с разбавленным раствором гидроксида натрия
В двух последних реакциях не образуется соединения с составом, соответствующим формуле 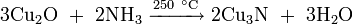 ). Образование оксида меди происходит через промежуточную гидратную форму переменного состава
). Образование оксида меди происходит через промежуточную гидратную форму переменного состава 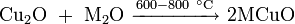 .
.
Просмотров: 8104
|
|