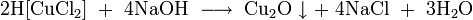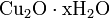Химия - Оксид никеля(II) - Химические свойства
15 июля 2011Оглавление:
1. Оксид никеля(II)
2. Химические свойства
3. Безопасность
Термически оксид никеля очень устойчив. Только при температурах выше 1230 °C становится заметна его обратимая диссоциация:
Проявляет амфотерные свойства, в воде практически не растворим:
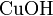 p ПР = 15,77
p ПР = 15,77
Реагирует с кислотами:
При спекании взаимодействует с щелочами и оксидами типичных металлов:
С концентрированным раствором аммиака образует амминокомплексы:
Восстанавливается водородом или другими восстановителями до металла:
При сплавлении с кислотными оксидами образует соли:
Применение
Основное применение оксида никеля — промежуточный продукт при получении солей никеля, никельсодержащих катализаторов и ферритов. Используется NiO как зелёный пигмент для стекла, глазурей и керамики. Объём производства оксида никеля около 4000 тонн/год .
Просмотров: 3425
|
|