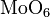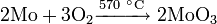Химия - Оксид олова(II) - Химические свойства
15 июля 2011Оглавление:
1. Оксид олова(II)
2. Химические свойства
Оксид олова устойчив на воздухе, амфотерен с преобладанием основных свойств. Мало растворим в воде и разбавленных растворах щелочей. Растворяется в разбавленных кислотах:
и концентрированных кислотах:
Он также растворяется в сильных кислотах, давая ионные комплексы, например Sn3 или Sn, также в менее кислотных растворах — Sn34.
Растворяется в концентрированных щелочах:
Также известны другие безводные оловосодержащие соединения, например, K2Sn2O3, K2SnO2.
Диспропорционирует при нагревании:
Окисляется кислородом воздуха:
Восстанавливается до металлического олова водородом, углеродом, кремнием, бором и парами этилового спирта.:
Sn и O могут образовывать соединения нестехиометрического состава.
Применение
Оксид олова в подавляющем большинстве случаев используется в качестве исходного продукта в производстве других, как правило, двухвалентных, соединений олова. Может применяться также в качестве восстановителя и в создании рубинового стекла. В незначительных количествах используется в качестве этерификаторного катализатора.
Оксид церия с оксидом олова используется в осветительных приборах как люминофор.
Просмотров: 4177
|
|